LA MEZCLA DE CEMENTO DE CALCIO ENRIQUECIDO ES UTIL EN LA CURACION OSEA DE LAS LESIONES PERIRRADICULARES
Para lograr la curación ósea, han sido sugeridos distintos materiales, sustitutos óseos o membranas de barrera para ser utilizados durante la cirugía perirradicular. La mezcla de cemento de calcio enriquecido puede aplicarse como relleno radicular o sustituto óseo. Se presenta un caso en el que se utilizó este material para el abordaje quirúrgico por endodoncia de una lesión periapical extensa.
Institución del autor
Shahid Beheshti University of Medical Sciences, Teherán, Irán
Primera edición en siicsalud
3 de junio, 2011
Introducción
El tratamiento apropiado de la superficie de una raíz resecada y del canal radicular expuesto son los pasos más importantes en la cirugía perirradicular. Lograr un cierre hermético es el principal objetivo en este tipo de cirugías. Esto se consigue mediante la preparación de la cavidad radicular con el relleno adecuado. El agregado de trióxido mineral (MTA) ha sido sugerido para cumplir con este objetivo. El MTA permite la dentinogénesis y la cementogénesis, y cuando se implanta en tejido óseo tiene una buena biocompatibilidad. Sin embargo, a pesar de su excelente biocompatibilidad tisular, el MTA presenta algunos inconvenientes, tales como actividad antimicrobiana cuestionable, tiempo de colocación prolongado, difícil manipulación, potencial decoloración y alto costo.
Los injertos o sustitutos óseos también han sido recomendados para promover la curación del hueso durante la cirugía perirradicular. En la bibliografía se sugieren distintos materiales para este propósito. El material ideal debe ser biocompatible, biorreabsorbible, osteoconductor, osteoinductor, de estructura similar al hueso, fácil de usar, así como efectivo en relación con el costo. Aunque el hueso autógeno ha demostrado ser el material de injerto más exitoso y adecuado, su disponibilidad limitada, el prolongado tiempo de operación y la morbilidad del sitio donante constituyen desventajas significativas que inclinan la balanza a favor de otros biomateriales o injertos. La mayoría de los materiales de injerto presentan distintos niveles de debilidad; sin embargo, los biomateriales carecen de complicaciones inmunológicas e infecciosas y se han ganado un lugar en la cirugía perirradicular.
En la actualidad, diversos biomateriales se utilizan para facilitar la curación ósea, como por ejemplo, el sulfato de calcio, el fosfato tricálcico, el fosfato de calcio bifásico, el silicato de calcio, la hidroxiapatita, el vidrio o la cerámica bioactiva y los compuestos de polímeros biocompatibles. Recientemente, se ha elaborado una mezcla de cemento de calcio enriquecido (MCCE) integrado por distintos componentes cálcicos. La MCCE es biocompatible y permite estimular la curación de los tejidos duros, mediante, por ejemplo, la dentinogénesis y la cementogénesis. A su vez, forma un cierre efectivo cuando se utiliza como material de relleno radicular. Esta mezcla ha demostrado tener propiedades únicas, como la formación de hidroxiapatita sobre la raíz resecada y el llenado de la superficie radicular, aun en solución salina normal. Como relleno radicular, presenta características de superficie similares a las de la dentina circundante. Más aún, tiene un efecto antibacteriano comparable al del hidróxido de calcio y mayor que el del MTA, además de un menor costo.
El objetivo de este trabajo fue describir el abordaje quirúrgico de un incisivo central maxilar asociado con una lesión inflamatoria periapical, en el que se utilizó MCCE como material de relleno radicular y sustituto óseo.
Descripción del caso
Un paciente de 53 años, de sexo masculino, con una historia clínica sin datos relevantes, fue derivado para cirugía perirradicular del incisivo central maxilar derecho. El paciente se quejaba de tumefacción periódica, dolor y molestias, sensibilidad a la percusión y leve movimiento dentario. La historia odontológica previa incluía un tratamiento de conducto no quirúrgico del diente involucrado que se había llevado a cabo hacía 7 años.
El examen extraoral no arrojó ningún resultado significativo. Sin embargo, en el examen intraoral se observó una leve tumefacción en el vestíbulo bucal. El paciente presentaba sensibilidad a la palpación en esta región. Los márgenes coronales parecían estar intactos, tanto clínicamente como radiológicamente. El examen clínico de los dientes y tejidos circundantes no reveló ningún otro síntoma o signo clínico. En la radiografía se observó una imagen radiolúcida amplia periapical en el ápice del incisivo central maxilar derecho, que había sido restaurado con un perno y relleno radicular (Figura 1A). Se diagnosticó periodontitis apical crónica. La naturaleza del procedimiento quirúrgico y las posibles molestias y riesgos fueron explicadas extensamente al paciente y se obtuvo el consentimiento informado.
Durante la sesión en que se practicó el procedimiento, se prescribió un comprimido de 400 mg de ibuprofeno para prevenir el dolor posquirúrgico. También se prescribió un enjuague bucal antiséptico (gluconato de clorhexidina al 0.2%) y se realizó la anestesia local con lidocaína al 2%, la cual contenía 1:80 000 de adrenalina.
Se levantó un colgajo mucoperióstico de espesor completo que reveló una fenestración ósea bucal periapical y una lesión inflamatoria que involucraba el ápice dentario. El punto más profundo de la lesión apical era de 12 mm, aproximadamente, y el ancho de la lesión, de alrededor de 10 x 14 mm. La lesión inflamatoria estaba separada circunferencialmente de la cripta ósea y del diente, por lo que pudo ser extraída y colocada en solución de formol al 10% para su posterior examen histológico.
Se llevó a cabo una resección radicular de aproximadamente 2 mm en forma perpendicular al eje longitudinal de la raíz. Se preparó una cavidad radicular de 3 mm de profundidad mediante ultrasonido, utilizando un dispositivo piezoeléctrico con retropunta ultrasónica DT-043. Se mezcló el polvo y el líquido de la MCCE de acuerdo con las instrucciones del fabricante y se colocó en la cavidad radicular. A continuación, el defecto óseo fue rellenado gradualmente mediante el agregado del polvo de la MCCE a la sangre. El colgajo mucoperióstico fue suturado en el lugar con sutura de PVDF 4-0 y se tomó una radiografía periapical para confirmar la precisión de las maniobras quirúrgicas (Figura 1B).
Siete días después de la cirugía se retiraron las suturas y se observó la cicatrización posquirúrgica, la cual estaba progresando sin inconvenientes. El examen histopatológico de la lesión (cortes teñidos con hematoximina y eosina) mostró fragmentos de tejido conectivo inflamatorio cubierto por epitelio escamoso estratificado no queratinizado, el cual contenía numerosos anillos hialinos. El diagnóstico fue compatible con un quiste perirradicular.
El paciente fue revisado a las 2, 3 y 4 semanas posteriores a la cirugía. Estas visitas de seguimiento incluyeron el examen intraoral de rutina y el control profesional de la placa. Cinco meses después de la cirugía no había signos o síntomas clínicos de inflamación, dolor a la percusión o palpación, molestias, movilidad, formación de fístula o de bolsa periodontal. Es interesante destacar que la radiografía reveló una reabsorción casi completa de la MCCE con el consiguiente reemplazo por hueso nuevo en las visitas de seguimiento a los 5 meses y al año posterior a la cirugía (Figuras 1C y 1D). El paciente se encontraba completamente satisfecho con los resultados del tratamiento.
Discusión
El abordaje quirúrgico de las lesiones periapicales crónicas ha sido propuesto en la bibliografía para aquellos casos en los que la preparación quimiomecánica de la terapia endodóncica ortógrada parece no permitir eliminar todos los agentes que se encuentran dentro del sistema del conducto radicular. La técnica quirúrgica y los tipos de relleno radicular utilizados afectan significativamente los resultados del tratamiento y el pronóstico de la cirugía endodóncica. Está aceptado que un material de relleno radicular hidrófobo requiere una cavidad completamente seca, libre de sangre o saliva. Afortunadamente, la MCCE es un cemento de base acuosa (hidrófilo) y requiere un ambiente húmedo para ser utilizado. La habilidad de sellado de la MCCE es comparable a la del MTA y superior a la del material de restauración intermedio. La MCCE libera tanto iones de calcio como de fosfato a partir de fuentes endógenas. Estos elementos se utilizan en el proceso de la producción de hidroxiapatita y su posterior precipitación sobre la superficie, no sólo en medio fosfato salino sino también en solución salina normal. Los resultados de un estudio histológico reciente revelaron que la MCCE induce la cicatrización dentoalveolar, particularmente la cementogénesis. Esta habilidad puede explicar parcialmente los resultados favorables del presente caso.
El tamaño de la lesión periapical puede ser un factor de fundamental importancia, así como el espacio entre los tejidos duros y blandos puede establecer la naturaleza de tejido que crecerá durante la curación. Si se establece primero tejido fibroso, probablemente actuará como barrera y evitará la formación ósea. De modo inverso, algunos investigadores han sugerido que el tamaño de la lesión periapical no tendría relación con la resolución final del defecto. Otros informaron que las lesiones de tamaño pequeño y mediano (menores de 10 mm) se curaban en un período de alrededor de 7 meses, y que lesiones más grandes lo hacían en un lapso de 11 meses. Las terapias regenerativas constituyen el método de elección en el tratamiento de los defectos periapicales extensos. El uso de una matriz de barrera obtuvo efectos beneficiosos en la tasa de curación ósea. La lesión mayor de 10 mm del presente caso se curó dentro de los 5 meses, lo cual sugiere que el uso adicional del biomaterial de MCCE combinado con la terapia quirúrgica convencional de las lesiones periapicales crónicas puede dar resultados clínicos mejores y más rápidos. Podemos postular como hipótesis que realizar endodoncia quirúrgica con polvo de MCCE como sustituto óseo podría acelerar la reabsorción del material, y como matriz podría acelerar y asistir en la formación de hueso.
Durante el tratamiento quirúrgico del presente caso, no se utilizó una técnica costosa con membrana de barrera. Los investigadores han sugerido que la colocación de una membrana sobre la apertura ósea creada durante un procedimiento de cirugía perirradicular no aporta ventajas en la curación ósea. Además, cuando se levantó el colgajo, el periostio estaba intacto. Es bien sabido que el periostio es la fuente de células osteocompetentes, con lo que evita la migración apical del epitelio durante las fases tempranas de la reparación de la herida y contribuye, con el tiempo, a la formación de hueso nuevo. En este caso, la curación fue parcialmente de naturaleza perióstica.
Un área radioopaca en la zona central de la lesión ya cicatrizada se observa en la Figura 1C (a los 5 meses de seguimiento). Estudios sobre endodoncia indican que la formación ósea en las lesiones perirradiculares tiene lugar de la periferia hacia el centro. Asumimos que esta área puede contener partículas de polvo de MCCE remanentes que irán desapareciendo progresivamente con el tiempo (Figura 1D). En el presente estudio, la curación fue evaluada a partir de la imagen radiográfica. El hallazgo radiográfico de curación ósea no indica necesariamente regeneración. Por lo tanto, idealmente se requiere un examen histológico. Desde la perspectiva clínica, la biopsia es difícil de obtener por razones éticas, por lo que los resultados del tratamiento que se observan en la radiografía deberían ser interpretados como prueba de curación en ausencia de análisis histológicos.
Sobre la base de los resultados favorables del tratamiento puede concluirse que la aplicación de la técnica de regeneración ósea con polvo de MCCE presenta resultados satisfactorios en el corto plazo. Este abordaje regenerativo puede ser considerado como un complemento de la cirugía perirradicular.
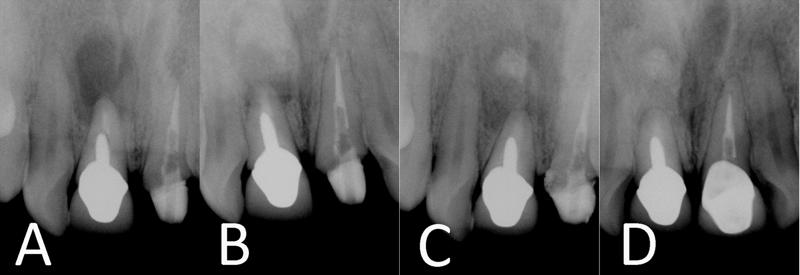
Figura 1. A) Radiografía preoperatoria; B) Radiografía del posquirúrgico inmediato; C) Radiografía a los cinco meses de seguimiento; D) Radiografía al año de seguimiento.
Abbreviations:
CEM: Calcium enriched mixture
H & E: Hematoxylin and eosin
IRM: Intermediate restorative material
MTA: Mineral trioxide aggregate
Introduction
Precise management of the resected root-end surface and exposed root canal are the most important steps in periradicular surgery.1 Achieving a hermetic seal is main objective of periradicular surgery; this is attained by root-end cavity preparation with a subsequent suitable root-end filling.2 Mineral trioxide aggregate (MTA) have been suggested for this approach. MTA allows dentinogenesis,3 cementogenesis4 and when implanted in bone tissue, it has good biocompatibility.5 However, despite its excellent tissue biocompatibility, MTA has some drawbacks such as questionable antimicrobial activity, prolonged setting time, difficult handling properties, potential discoloration, and a high cost.6-8
Bone grafts/substitutes have also been recommended to promote bone healing during periradicular surgery.9-10 Literature has suggested numerous materials for this purpose. The ideal material should be biocompatible, bioresorbable, osteoconductive, osteoinductive, structurally similar to bone, easy to use, as well as cost-effective.11 Although autogenous bone has been shown to be the the most successful and suitable grafting material;12 the limited availability, prolonged operation time, and donor site morbidity are significant disadvantages that shift the scales in favor of other grafts/biomaterials.13-14 Most of the grafting materials have shown various levels of weakness; biomaterials however, avoid immunogenic and infectious complications15 and have a place in periradicular surgery.
Currently several biomaterials are used to facilitate bone healing i.e. calcium sulfate, tricalcium phosphate, biphasic calcium phosphate, calcium silicate, hydroxyapatite, bioactive glass/ceramics, and biocompatible composite polymers.17 Recently, calcium enriched mixture (CEM) cement consisting of different calcium compounds has been developed.8 CEM is biocompatible and able to stimulate hard tissue healing i.e. dentinogenesis3 and cementogenesis;4 it also forms an effective seal when used as root-end filling material.2 CEM showed unique properties such as hydroxyapatite formation over the resected root-end and root-end filling surface, even in normal saline;18 as a root-end filling, it exhibits surface characteristics similar to surrounding dentin.19 Moreover, it has antibacterial effect comparable to calcium hydroxide and greater than MTA;7 as well as a lower cost.
The purpose of this report is to describe the surgical management of a maxillary central incisor associated with a periapical inflammatory lesion with CEM as root-end filling material in tandem with bone substitute.
Case Report
A 53-year-old male patient with a noncontributory medical history was referred for periradicular surgery on the maxillary right central incisor. The patient’s complaint was of periodic swelling, pain and discomfort, sensitivity on percussion and slight tooth mobility. Previous dental history included nonsurgical root canal treatment of the involved tooth performed 7 years previously.
The extraoral examination was unremarkable; however during intraoral examination mild swelling was noted in the buccal vestibule. Patient was sensitive to palpation in this region. Crown margins appeared intact clinically and radiographically. Clinical examination of the surrounding teeth and tissues did not reveal any other clinical signs or symptoms. Radiographical examination showed a large periapical radiolucency at the apex of maxillary right central incisor which was restored with a post and root canal filling (Illustration 1A). A diagnosis of chronic apical periodontitis was made. The nature of the surgical procedure and possible discomforts and risks were extensively explained to the patient and informed consent obtained.
In the operative session, a 400 mg tablet of Ibuprofen (Darou Pakhsh, Tehran, Iran) was prescribed to prevent post-treatment pain. An antiseptic mouthwash (0.2% chlorhexidine gluconate) was then prescribed and teeth were locally anesthetized with 2% Lidocaine containing 1:80000 adrenaline (Darou Pakhsh, Tehran, Iran).
A full-thickness mucoperiosteal flap was raised revealing a periapical buccal bone fenestration and an inflammatory lesion involving the apex of tooth. The deepest point of the apical lesion was ~12 mm, and the width of the lesion was ~10 × 14 mm. The inflammatory lesion was then circumferentially detached from the bony crypt and teeth; it was then removed and stored in 10% buffered formalin solution for further histological evaluation.
Approximately 2 mm root-end resection was performed perpendicular to the long axis of the root. A 3-mm deep root-end cavity was prepared ultrasonically, powered by a minipiezon with DT-043 ultrasonic retrotip (EMS, Nyon, Switzerland). CEM cement (BioniqueDent, Tehran, Iran) powder and liquid was mixed according to manufacturer’s instructions and inserted into the root-end cavity. Afterwards, the bone defect was filled incrementally by adding the CEM cement powder to blood. The mucoperiosteal flap was sutured in place with 4–0 PVDF sutures20 and a periapical radiograph was taken to confirm the accuracy of the surgical manipulations (Illustration 1B).
Seven days postoperatively sutures were removed and postoperative healing was observed; the healing proceeded uneventfully. Histopathological examination (H & E stained sections) of the lesion showed fragments of inflammatory connective tissue lined by non-keratinized stratified squamous epithelium containing many hyaline rings. The diagnosis was consistent with a periradicular cyst.
Patient was seen 2, 3 and 4 weeks postoperatively; these follow-up visits included routine intraoral examinations and professional plaque control. Five months following the surgical procedure there were no clinical signs and/or symptoms of inflammation, tenderness to percussion or palpation, reports of pain or discomfort, mobility, sinus tract formation and periodontal pocket formation. Interestingly, radiographic examination revealed the almost complete resorption of CEM cement and subsequent replacement with new bone at the 5 month and one year follow up sessions (Illustrations 1C and 1D). Patient was completely satisfied with the results of the treatment.
Discussion
Surgical management of chronic periapical lesion has been proposed in the literature in cases in which the chemomechanical preparation of orthograde endodontic therapy appears incapable of eliminating all the irritants located within the root canal system.2,4,21 Surgical technique and the types of root-end filling utilized significantly affect treatment outcome and prognosis of endodontic surgery.22 It is well-accepted that a hydrophobic root-end filling material requires completely dry cavity, free of blood and saliva. Fortunately, CEM is a water-based (hydrophilic) cement and requires a wet environment to set.8,19 CEM cement’s sealing ability is comparable to MTA and superior to IRM.2 CEM releases both calcium and phosphate ions from indigenous sources; these elements are used in the process of hydroxyapatite production and subsequent precipitation over its surface, not only in PBS but also in normal saline solution.18 The results of a recent histological study revealed that CEM induced dentoalveolar healing, particularly cementogenesis.4,23 This ability may partially explain the favorable results of the present case.
The size of the periapical lesion may be an imperative factor as the space between the hard and soft tissues could establish the nature of tissue that will grow during healing. If fibrous tissue establishes itself first, it will possibly act as a barrier to prevent bone formation.24 Conversely, some researchers have suggested that the size of the periapical lesion has no bearing on the final resolution of the defect.25 Others reported that small and medium size lesions (<10 mm) healed within ~7 months, and larger lesions healed within 11 months.26 Regenerative therapies are known as the preferable methods in the treatment of large periapical defects; the use of matrix barrier had beneficial effect on the rate of osseous healing.27-28 The >10 mm lesion in the present case healed within ~5 months which suggests that the additional use of CEM biomaterial with conventional surgical therapy of chronic periapical lesions may result in improved and speedier clinical outcomes. We can hypothesize that conducting surgical endodontics with CEM cement powder as bone substitute might accelerate the resorption of the material and as a matrix might accelerate and assist bone formation.
During the surgical management of the present case, an expensive barrier membrane technique was not used; researchers suggested that placement of a membrane over the bony opening created during a periradicular surgical procedure has no advantage on osseous bone healing.29-30 Moreover, when the flap was raised, the periosteum was intact; it is well known that periosteum is the source of osteocompetent cells, preventing apical migration of the epithelium during the early phases of wound repair, and contributing to new bone formation over time.31-32 In this case healing was partially periosteal in nature.33
An area of radiopacity in the central area of the healed lesion was noted in Illustration 1C (5 month follow up). Endodontic literature reveals that bone formation in periradicular lesions had taken place from the periphery to the center.33 We assumed that this area may contain remaining CEM powder particles which will be removed progressively with time (as shown in Illustration 1D). In the present study, healing was evaluated on the evidence of the radiographic appearance. The radiographic evidence of osseous bone healing does not inevitably indicate regeneration; hence histologic examination is ideally needed. From the clinical perspective, biopsy is difficult to obtain for ethical reasons, therefore the radiographic treatment outcomes should be interpreted as evidence of improved healing in the absence of histological analyses.34
Based on the favorable treatment outcomes it can be concluded that the application of bone regeneration technique with CEM cement powder yields satisfactory results in the short term. This regenerative approach may be considered as an adjunct to periradicular surgery.

Figure 1. A) preoperative radiograph; B) Immediate postoperative radiograph; C) Five-month follow-up radiograph; and D) 1-year follow-up radiograph




