 Resumen
Introducción: La prevalencia de parasitosis decreciente de norte a sur en la Argentina, ha llevado a la comunidad científica a enfocar sus estudios epidemiológicos hacia las zonas más vulnerables y desatender a las poblaciones de la Patagonia (sur de Argentina). Los objetivos del presente estudio fueron: determinar la prevalencia de parásitos intestinales en niños y jóvenes de Puerto Madryn (Chubut, Patagonia), y evaluar las infecciones parasitarias en relación con los factores socioambientales y las prácticas de higiene de la población. Materiales y métodos: Se procesaron muestras seriadas de materia fecal mediante las técnicas Ritchie modificada y FLOTAC dual pellet, y muestras de escobillado anal por sedimentación. Se relevaron las variables socioambientales y las prácticas de higiene de los participantes mediante cuestionarios semiestructurados. Resultados: El 39.1% (68/174) de la población analizada estuvo parasitado. Se halló un total de 6 especies parásitas, las más prevalentes de las cuales fueron Blastocystis sp (19.0%), Enterobius vermicularis (17.8%) y Giardia lamblia (6.3%). El riesgo de parasitosis y de infección por Blastocystis sp fue mayor en los participantes que no poseían agua de red (odds ratio [OR] = 2.9 y OR = 3.2, respectivamente). La infección por G. lamblia se asoció de manera positiva con la falta de recolección pública de residuos (OR = 5.6). La infección por E. vermicularis fue superior en los participantes con padres que tenían un nivel de estudios primario (OR = 5.0). Conclusión: Las infecciones parasitarias observadas reflejan las condiciones ambientales de la Patagonia y la necesidad de orientar los estudios a poblaciones periféricas de los centros urbanos, las cuales están expuestas a mayor vulnerabilidad socioeconómica.
Resumen
Introducción: La prevalencia de parasitosis decreciente de norte a sur en la Argentina, ha llevado a la comunidad científica a enfocar sus estudios epidemiológicos hacia las zonas más vulnerables y desatender a las poblaciones de la Patagonia (sur de Argentina). Los objetivos del presente estudio fueron: determinar la prevalencia de parásitos intestinales en niños y jóvenes de Puerto Madryn (Chubut, Patagonia), y evaluar las infecciones parasitarias en relación con los factores socioambientales y las prácticas de higiene de la población. Materiales y métodos: Se procesaron muestras seriadas de materia fecal mediante las técnicas Ritchie modificada y FLOTAC dual pellet, y muestras de escobillado anal por sedimentación. Se relevaron las variables socioambientales y las prácticas de higiene de los participantes mediante cuestionarios semiestructurados. Resultados: El 39.1% (68/174) de la población analizada estuvo parasitado. Se halló un total de 6 especies parásitas, las más prevalentes de las cuales fueron Blastocystis sp (19.0%), Enterobius vermicularis (17.8%) y Giardia lamblia (6.3%). El riesgo de parasitosis y de infección por Blastocystis sp fue mayor en los participantes que no poseían agua de red (odds ratio [OR] = 2.9 y OR = 3.2, respectivamente). La infección por G. lamblia se asoció de manera positiva con la falta de recolección pública de residuos (OR = 5.6). La infección por E. vermicularis fue superior en los participantes con padres que tenían un nivel de estudios primario (OR = 5.0). Conclusión: Las infecciones parasitarias observadas reflejan las condiciones ambientales de la Patagonia y la necesidad de orientar los estudios a poblaciones periféricas de los centros urbanos, las cuales están expuestas a mayor vulnerabilidad socioeconómica.
 Palabras clave
población infantojuvenil
Palabras clave
población infantojuvenil
 Abstract
Abstract
Introduction: The decreasing prevalence of parasitosis from north to south in Argentina has led the scientific community to focus the epidemiological studies on the most vulnerable areas and, consequently, neglect the populations of Patagonia (South Argentina). The objectives of the present study were (i) to determine the prevalence of intestinal parasites in children and youth of Puerto Madryn (Chubut province, Patagonia), and (ii) to evaluate the parasitic infections found concerning socio-environmental factors and hygiene practices of the population. Materials and methods: Serial stool samples were processed using modified Ritchie and FLOTAC dual pellet techniques, and samples of anal swabs were examined by sedimentation. Socio-environmental variables and hygiene practices of the participants were surveyed using a semi-structured questionnaire. Results: Of all examined participants, 39.1% (68/174) were parasitized. A total of 6 parasite species were found and the most prevalent were Blastocystis sp (19.0%), Enterobius vermicularis (17.8%), and Giardia lamblia (6.3%). The risk of parasitosis and infection for Blastocystis sp was greater in participants who lived in houses without piped water (OR = 2.9 and OR = 3.2, respectively). The risk of infection for G. lamblia was positively associated with the lack of public waste collection service (OR = 5.6). Infection for E. vermicularis was higher in participants whose parents had a basic level of education (OR = 5.0). Conclusion: The parasitic infections observed reflect the environmental conditions of Patagonia and the need to focus studies on populations from peripheral areas to urban centers that are exposed to greater socio-economic vulnerability.
Artículo completo
PARASITOS INTESTINALES EN POBLACIONES INFANTOJUVENILES; AMBIENTE Y COMPORTAMIENTO SOCIAL
(especial para SIIC © Derechos reservados)
Introducción
Las parasitosis intestinales se incluyen entre las enfermedades infecciosas desatendidas, y afectan a millones de personas en el mundo, principalmente a niños de países en vías de desarrollo.1,2La transmisión de los parásitos intestinales (por ej., Giardialamblia, Ascarislumbricoides, Enterobiusvermicularis) se relaciona principalmente con factores ambientales y sociales. Al respecto, factores ambientales como la temperatura, la precipitación, la cobertura vegetal y las características del suelo, pueden afectar directamente la supervivencia y dispersión de las formas parásitas.3 Del mismo modo, la presencia de estas infecciones en la población humana se ve favorecida por la falta de acceso a agua segura y a un sistema de red cloacal, a la educación y las prácticas de higiene insuficientes, así como a la escasa capacitación en el diagnóstico y tratamiento de estas enfermedadaes.2,4 En este contexto, diversos estudios han contribuido al conocimiento de la epidemiología de las enteroparasitosis en países de América del Sur.5-11
Argentina presenta una amplia variabilidad ambiental y socioeconómica, y por ello es posible observar una distribución de parásitos intestinales heterogénea. La mayoría de los parásitos cosmopolitas hallados frecuentemente en la población humana (por ej., G. lamblia, Blastocystissp, Entamoebacoli, E. vermicularis) se han informado en todo el territorio argentino, con mayores prevalencias en el centro y norte del país.4,10 Por otra parte, los helmintos transmitidos por el suelo –geohelmintos– (como A. lumbricoides, Strongyloidesstercoralis, Trichuristrichiura y anquilostomideos) se distribuyen principalmente en el norte del país.9,12-15 Por el contrario, en el sur de Argentina se han informado bajas prevalencias de parásitos intestinales en general, pero un alto índice de endemicidad de equinococosis quística causada por Echinococcus granulosus.4,16 Esta tendencia de prevalencia decreciente de norte a sur ha llevado a la comunidad científica a enfocar sus estudios epidemiológicos hacia las zonas más vulnerables y desatender a las poblaciones de la Patagonia, al sur de Argentina. No obstante, Soriano y col. (2005) han registrado un máximo de 11 especies de parásitos intestinales en asentamientos marginales de la provincia de Neuquén, con condiciones sanitarias inadecuadas y bajo nivel económico.17 Por otra parte, Navone y col. (2017) han informado un máximo de 6 especies parásitas en niños y jóvenes del oeste y centro de la provincia de Chubut.10 En este contexto, los objetivos del presente trabajo fueron: (i) determinar la prevalencia de parásitos intestinales en niños y jóvenes de Puerto Madryn (provincia de Chubut), y (ii) evaluar las infecciones parasitarias halladas en relación con los factores socioambientales y las prácticas de higiene de la población.
Materiales y métodos
Área de estudio
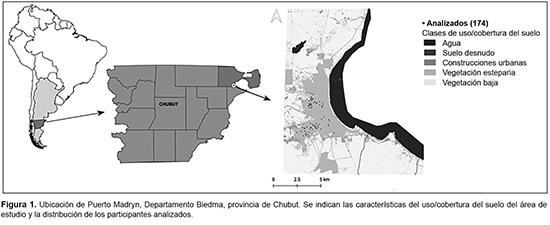
La ciudad de Puerto Madryn (42°46' S, 65°02' O) se ubica en el noreste de la provincia de Chubut, cercana a la reserva natural Península Valdés y sobre la costa del océano Atlántico. Posee un clima templado-árido por su proximidad al mar y por ubicarse a sotavento de la meseta patagónica. Presenta una temperatura media anual de 12 °C, y escasas precipitaciones (precipitación media anual de 160 mm), que se concentran principalmente en los meses de mayo y junio. Los suelos son pedregosos y muy pobres en materia orgánica. La zona urbana está rodeada principalmente de vegetación esteparia.18-20
Puerto Madryn es la ciudad cabecera del departamento de Biedma y representa un centro destacado en la actividad industrial, pesquera y turística. La actividad turística tiene dos estacionalidades muy marcadas, en invierno-primavera y en verano. Puerto Madryn posee 81 995 habitantes y permanentemente recibe familias de otras ciudades y de países limítrofes (principalmente de Bolivia y Paraguay), que construyen sus viviendas en las zonas periféricas de la ciudad como asentamientos no formales.21,22 La presencia de estos asentamientos constituye una problemática creciente para la ciudad, debido a que en los últimos años se han expandido aceleradamente, sin planificación gubernamental, hacia zonas no aptas para ser habitadas.19 El estudio se llevó a cabo en 5 centros de desarrollo infantil, en los cuales asisten principalmente niños de zonas periféricas de la ciudad de Puerto Madryn (Figura 1).
Análisis parasitológico
Se llevó a cabo un estudio transversal en mayo de 2017, que incluyó a participantes de ambos sexos menores de 14 años, que asistían a los centros de desarrollo infantil, así como a sus hermanos.
Se llevaron a cabo encuentros en los centros de desarrollo infantil con los padres de los niños y jóvenes, con el fin de informar acerca de la biología y los modos de transmisión de los enteroparásitos y las estrategias de prevención y control de las infecciones. Durante los encuentros, se repartieron dos frascos a cada participante para la recolección de muestras de materia fecal y de escobillado anal, previa instrucción verbal y escrita. Las muestras fueron colectadas por los padres y tutores de los niños durante 5 días consecutivos y fueron conservadas en formol 5%. Los escobillados anales fueron obtenidos cada mañana de la región perianal utilizando una gasa estéril. Los niños y jóvenes que aceptaron participar voluntariamente y que contaban con el consentimiento de sus padres y tutores formaron parte del estudio. Se excluyeron a los que hubieran recibido tratamiento antiparasitario al momento del relevamiento.
Las muestras de materia fecal fueron homogeneizadas, filtradas y procesadas mediante las técnicas Ritchie modificada y FLOTAC dual pellet con las soluciones flotantes SF2 (solución saturada de cloruro de sodio, densidad = 1.20) y SF3 (sulfato de zinc heptahidratado, densidad = 1.20).23,24 Los escobillados anales fueron agitados vigorosamente y centrifugados a 400 g por 10 minutos para el diagnóstico específico de E. vermicularis.25,26 Se realizaron coloraciones con lugol cuando fue necesario. El diagnóstico de las formas parásitas se efectuó mediante las características morfológicas usando microscopio óptico.27 La cuantificación de huevos de helmintos por gramo de heces (hpg) se realizó multiplicando el número de huevos por 4.24
Las familias y las instituciones recibieron los resultados del diagnóstico parasitológico, y los casos positivos fueron referidos a centros de salud para el tratamiento específico.
Análisis socioambiental
Los padres y tutores de los niños y jóvenes completaron voluntariamente un cuestionario semiestructurado con el fin de registrar las características de la vivienda y de la población analizada. Se indagó acerca del material de construcción de la vivienda y de la calle, la fuente de agua de consumo, la eliminación de excretas y residuos domésticos, y el hacinamiento (más de tres personas por dormitorio). Además, se examinó el nivel de educación y empleo de los padres, y la ayuda monetaria y alimentaria gubernamental, entre otras variables. Asimismo, se relevaron los hábitos de higiene, como el lavado de manos luego de tocar a las mascotas y de ir al baño y antes de comer, andar descalzo, jugar con tierra y comerse las uñas (onicofagia), lavado de frutas y verduras, y tratamiento de agua domiciliaria (es decir, por hervido o agregado de cloro).
Análisis estadístico
Se calculó la prevalencia (proporción de participantes parasitados sobre el total de participantes analizados), el número de especies parásitas en la población analizada y el porcentaje de infección simple (infección por una sola especie parásita) e infección múltiple (infección por 2 o más especies parásitas).
Para evaluar la asociación entre las infecciones parasitarias halladas y los factores socioambientales y las prácticas de higiene, se estimó la independencia entre variables utilizando la prueba de chi al cuadrado o el test exacto de Fisher (en caso de valores esperados menores de 5). Las variables que presentaron una asociación estadísticamente significativa (p < 0.05) fueron evaluadas mediante modelos de regresión logística utilizando la selección stepwise forward. El modelo seleccionado fue el que presentó menor desviación residual (DR) y, en el caso de hallar varios modelos competitivos, se seleccionó el más parsimonioso comparando el criterio de información de Akaike (AIC) y el valor de p. La fuerza de la asociación se estimó por los valores de odds ratio (OR), con intervalos de confianza del 95% (IC 95%). Los análisis estadísticos se realizaron utilizando el software R.28
Aspectos éticos
El trabajo se llevó a cabo sin afectar la integridad física, psíquica y moral de los participantes, con resguardo de su identidad y consentimiento oral y escrito firmado por padres o tutores. La presente investigación fue evaluada y aprobada por el Comité de Ética de la Escuela Latinoamericana de Bioética (CELABE) bajo la resolución Nº 003/2016 Acta 73. El estudio se ajustó a lo establecido en la Declaración Universal de los Derechos Humanos de 1948, las normas éticas instituidas por el Código de Núremberg de 1947 y la Declaración de Helsinki de 1964 y sucesivas enmiendas, atendiéndose especialmente a lo normado por el artículo 5° del Decreto Reglamentario de la ley nacional 25326.
Resultados
Se analizaron 174 niños y jóvenes de ambos sexos (51.1% mujeres y 48.9% varones) y menores de 14 años, con una mayoría de niños de 3 (31.0%), 4 (28.2%) y 5 años (11.5%).
El 39.1% (68/174) de la población analizada estuvo parasitada. La infección parasitaria fue mayor en las mujeres con respecto a los varones (55.9% y 44.1%, respectivamente) y en los niños de 4 años (32.4%), seguidos de los de 3 (23.5%) y 5 años (13.2%); sin embargo, no se observaron diferencias estadísticamente significativas (p > 0.05).
Se halló un total de 6 especies parásitas, las más prevalentes de las cuales fueron Blastocystissp (19.0%; n = 33), E. vermicularis (17.8%; n = 31) y G. lamblia (6.3%; n = 11), seguidas de E. coli (5.7%; n = 10), Endolimax nana e Hymenolepis nana (1.1%; n = 2 para ambas). La cuantificación de huevos de H. nana arrojó diferencias, hallándose un máximo de 956 hpg y 12 hpg en cada caso positivo, respectivamente.
La infección simple fue más frecuente (75.0%), en comparación con la infección múltiple (25.0%). Se observó una coinfestación estadísticamente significativa entre Blastocystissp y G. lamblia (Fisher = 0.035).
Respecto del análisis socioambiental, el 92.5% de los participantes analizados completaron el cuestionario (n = 161). La mayoría de las viviendas estaban construidas de mampostería de ladrillos (86.3%) y sobre calles de tierra (72.0%). El 81.4% de los participantes tenía agua de red, y el 18.0% consumían agua de canilla pública. La mayoría poseían red cloacal (61.5%); sin embargo, el 32.9% eliminaba sus excretas mediante pozo ciego. El 84.5% tenía acceso a la recolección pública de residuos domésticos. La mayoría de las familias habitaban viviendas que no se inundaban, o solo lo hacían esporádicamente. Por otra parte, el 39.8% presentaba hacinamiento y el 28.6% compartía cama simple. Respecto del nivel de educación de los padres, la mayoría completaron solo un nivel educativo primario. Generalmente, las madres eran amas de casa (57.8%), los padres eran empleados (47.8%) y recibían ayuda monetaria (47.8%). La mayoría de las familias tenían perros como mascotas (82.0%). Las características socioambientales se muestran en la Tabla 1.

Respecto de los hábitos de higiene, la mayoría de los participantes lavaban sus manos después de jugar con sus mascotas (47.2%) y de ir al baño (73.3%), así como antes de comer (67.7%). Generalmente, andaban descalzos (59.6% a veces y 12.4% siempre) y jugaban en el suelo en contacto directo con la tierra (55.9% a veces y 20.5% siempre). Por otro lado, más del 34.8% de los niños presentaba onicofagia. La mayoría de las familias que lavaban las frutas y verduras (90.7%), y aquellas que accedían al agua mediante canilla pública, no mostraron hábito de tratar el agua, y en caso de hacerlo, el tratamiento más utilizado era por hervido (24.2%).
Al evaluar las variables socioeconómicas como factores de riesgo, se halló que los participantes que no poseían agua de red presentaban mayor riesgo de infección parasitaria (OR = 2.9; IC 95%: 1.3 a 6.7) y de infección por Blastocystissp (OR = 3.2; IC 95%: 1.3 a 3.2). El riesgo de infección por G. lamblia fue mayor en los participantes que no tenían recolección pública de residuos domésticos (OR = 5.6; IC 95%: 1.4 a 22.7). Por otra parte, la presencia de E. vermicularis fue superior en los niños y jóvenes con padres que solo habían alcanzado estudios primarios (OR = 5.0; IC 95%: 1.4 a 17.9). Los factores de riesgo de infección se muestran en la Tabla 2.

Discusión
En el presente trabajo se evaluaron las infecciones por parásitos intestinales en poblaciones infantojuveniles de zonas periféricas de Puerto Madryn, en relación con factores socioambientales y conductas de higiene. El estudio fue realizado en mayo, el mes con mayor concentración de precipitaciones y el comienzo de actividades de turismo local e internacional.
Del total de la población analizada, el 39.1% estuvo parasitada al menos por una de las 6 especies halladas, las más prevalentes (< 20.0%) de las cuales fueron especies cosmopolitas y comunes en la población humana: Blastocystissp, E. vermicularisy G. lamblia. Asimismo, en la población analizada no se hallaron especies de geohelmintos. La prevalencia y el número de especies observados fueron bajos respecto de los hallados en el norte y centro de Argentina, donde se informaron prevalencias entre 59% y 95%, y hasta 13 especies parásitas.7,9-11,14,29-32 Por otra parte, en el norte de la Patagonia argentina, Soriano et al. (2005) observaron un porcentaje de infección del orden del 50% en barrios periféricos, y hasta del 92.9% en asentamientos marginales de la ciudad de Neuquén, cuando analizaron un total de 126 niños. Asimismo, hallaron las mismas especies que las observadas en el presente trabajo (Blastocystissp, E. vermicularis y G. lamblia). Del mismo modo, indicaron que la frecuencia de los geohelmintos fue baja y los niños que presentaron geohelmintiasis (es decir, T. trichiura, S. stercoralis) habían residido en los últimos años en las zonas endémicas del norte del país o Bolivia.17 Por otra parte, un estudio comparativo realizado en diversas provincias de Argentina, mostró que la prevalencia en otras poblaciones de Chubut (departamentos de Gaiman, Telsen, Gastre, Cushamen, Futaleufú y Languiñeo) fue similar a la encontrada en el presente trabajo (38.4%).10 Estos valores bajos de prevalencia hallados en poblaciones residentes en el sur, que son principalmente de nacionalidad argentina, pueden deberse a que las condiciones climáticas (bajas temperaturas, escasas precipitaciones) y del suelo (vegetación esteparia en un suelo árido) limiten la persistencia y transmisión de formas parasitarias en el agua y suelo.4,33
Respecto de las variables socioambientales como factores de riesgo de infección parasitaria, se observó que no tener acceso a servicios públicos, como agua de red y recolección de residuos domésticos, incrementó el riesgo de tener parásitos intestinales (por ej., Blastocystissp y G. lamblia). Blastocystissp y G. lamblia son parásitos que infectan tanto a la población humana como animal, y ambos comparten el mismo modo de transmisión a través del consumo de agua y alimentos o el uso de objetos contaminados con materia fecal.34,35 Asimismo, la coinfestación de ambas especies parásitas hallada en el presente trabajo, junto con la presencia de otros protozoos (como E. coli y E. nana) reflejan la contaminación fecal del ambiente y las deficiencias de la higiene a la cual está expuesta la población.7,36
Por otra parte, el nivel educativo de los padres representó un factor de riesgo de infección por E. vermicularis. La transmisión de esta especie parásita ocurre a través de la vía ano-mano-boca, que está favorecida por algunos comportamientos de la población analizada (onicofagia, hacinamiento, falta de lavado de manos), por lo cual, la ausencia de información acerca de la transmisión de las parasitosis podría incrementar el riesgo de infección.37-40
Conclusiones
En conclusión, los resultados del presente estudio muestran que las infecciones por parásitos intestinales, a pesar de observarse con baja prevalencia, reflejan la vulnerabilidad ambiental y socioeconómica de la población. El acceso al agua segura, a condiciones adecuadas de saneamiento ambiental y a las prácticas de higiene apropiadas (WASH), han demostrado reducir la transmisión parasitaria.41,42 En este sentido, el trabajo integrado de la comunidad científica, educativa y gubernamental, mediante actividades de diagnóstico, prevención y control de las parasitosis junto a acciones de divulgación y capacitación, son esenciales para disminuir el riesgo de infección parasitaria y lograr el mejoramiento de la calidad de vida de la población.
|
 Bibliografía del artículo
Bibliografía del artículo
1. Organización Mundial de la Salud (OMS). World Health Assembly. Provisional agenda item 13.3: Communicable diseases. Control of schistosomiasis and soil-transmitted helminth infections. Report by the secretariat. Geneva: OMS; 2001.
2. Organización Panamericana de la Salud (OPS). Neglected infectious diseases in the Americas. Success stories and innovation to reach the neediest. Washington, D.C.: OPS; 2016. Disponible en: http://iris.paho.org/xmlui/handle/123456789/31250.
3. Lal A, Baker MG, Hales S, French NP. Potential effects of global environmental changes on cryptosporidiosis and giardiasis transmission. Trends Parasitol 29(2):83-90, 2013.
4. Juárez M, Rajal V. Parasitosis intestinales en Argentina: principales agentes causales encontrados en la población y en el ambiente. Rev Argent Microbiol 45(3):191-204, 2013.
5. Chammartin F, Scholte RGC, Malone JB, Bavia ME, Nieto P, Utzinger J, et al. Modelling the geographical distribution of soil-transmitted helminth infections in Bolivia. Parasites Vectors 6:152, 2013.
6. Chammartin F, Guimarães LH, Scholte RGC, Bavia ME, Utzinger J, Vounatsou P. Spatio-temporal distribution of soil-transmitted helminth infections in Brazil. Parasites Vectors 7:440, 2014.
7. Gamboa MI, Giambelluca LA, Navone GT. Distribución espacial de las parasitosis intestinales en la ciudad de La Plata, Argentina. Medicina (B. Aires) 74:363-370, 2014.
8. Zonta ML, Susevich ML, Gamboa MI, Navone GT. Parasitosis intestinales y factores socioambientales: Estudio preliminar en una población de horticultores. Salud i Ciencia 21:814-823, 2016.
9. Rivero MR, De Ángelo C, Núñez P, Salas M, Motta CE, Chiaretta A, et al. Environmental and socio-demographic individual, family and neighborhood factors associated with children intestinal parasitoses at Iguazú, in the subtropical northern border of Argentina. PLoS Negl Trop Dis 11(11):e0006098, 2017.
10. Navone GT, Zonta ML, Cociancic P, Garraza M, Gamboa MI, Giambelluca LA, et al. Estudio transversal de las parasitosis intestinales en poblaciones infantiles de Argentina. Rev Panam Salud Publica 41:e24, 2017.
11. Cociancic P, Torrusio SE, Zonta ML, Navone GT. Risk factors for intestinal parasitoses among children and youth of Buenos Aires, Argentina. One Health 9:100116, 2019.
12. Barda B, Cajal P, Villagrán E, Cimino R, Juárez M, Krolewiecki A, et al. Mini-FLOTAC, Kato-Katz and McMaster: three methods, one goal; highlights from north Argentina. Parasites Vectors 7:271, 2014.
13. Socías ME, Fernández A, Gil JF, Krolewiecki AJ. Geohelmintiasis en la Argentina. Una revisión sistemática. Medicina (B. Aires) 74:29-36, 2014.
14. Zonta ML, Oyhenart EE, Navone GT. Socio-environmental variables associated to malnutrition and intestinal parasitoses in the child population of Misiones, Argentina. Am J Hum Biol 26:609-616, 2014.
15. Zonta ML, Cociancic P, Oyhenart EE, Navone GT. Intestinal parasitosis, undernutrition and socio-environmental factors in schoolchildren from Clorinda Formosa, Argentina. Rev Salud Pública 21(2):224-231, 2019.
16. Costamagna SR, Visciarelli EC. Parasitosis regionales. Un estudio referido a las principales parasitosis de Bahía Blanca, Provincia de Buenos Aires, Argentina. 2da. ed. Buenos Aires: Editorial de la Universidad Nacional del Sur; 2008.
17. Soriano SV, Manacorda AM, Pierángeli NB, Navarro MC, Giayetto AL, Barbieri LM, et al. Parasitosis intestinales y su relación con factores socioeconómicos y condiciones de hábitat en niños de Neuquén, Patagonia, Argentina. Parasitol Latinoam 60:154-161, 2005.
18. Burkart R, Bárbaro N, Sánchez R, Gómez D. Eco-regiones de la Argentina. Buenos Aires: Administración de Parques Nacionales, Programa de Desarrollo Institucional Ambiental; 1999.
19. Ferrari MP. Configuraciones del riesgo y percepción social. Los asentamientos La Lomita y Alta Tensión, Puerto Madryn, Chubut. Geograficando 13:e024, 2017.
20. Cociancic P. Evaluación del riesgo de infecciones parasitarias intestinales en poblaciones infanto-juveniles de Argentina: el impacto de los factores ambientales y socio-económicos en su distribución geográfica. Tesis Doctoral. Universidad Nacional de La Plata, 2019. Disponible en: http://sedici.unlp.edu.ar/handle/10915/73477.
21. INDEC. Instituto Nacional de Estadística y Censos (INDEC). Argentina, Ministerio de Economía de la Nación. Censo Nacional de Población, Hogares y Vivienda 2010, 2010. Disponible en: http://www.indec.gov.ar.
22. Ferrari MP, Bozzano H. Aplicación del Método Territorii en dos asentamientos espontáneos de Puerto Madryn, Argentina. Papeles de Geografía 62:137-151, 2016.
23. Organización Mundial de la Salud (OMS). Basic laboratory methods in medical parasitology. Geneva: OMS; 1991.
24. Cringoli G, Rinaldi L, Maurelli MP, Utzinger J. FLOTAC: new multivalent techniques for qualitative and quantitative copromicroscopic diagnosis of parasites in animals and humans. Nature Protocols 5(3):503-515, 2010.
25. Organización Mundial de la Salud (OMS). Medios Auxiliares para el diagnóstico de las parasitosis intestinales. Ginebra: OMS; 1994.
26. Kaminsky RG. Manual de parasitología: técnicas para Laboratorio de Atención Primaria de Salud y para el diagnóstico de las Enfermedades Infecciosas Desatendidas. 3ra ed. Tegucigalpa, Honduras; 2014.
27. Ash L, Orihel T. Atlas de Parasitología Humana. 5ta. ed. Buenos Aires: Editorial Médica Panamericana; 2013.
28. R Core Team. R: A language and environment for statistical computing. Vienna, Austria: R Foundation for Statistical Computing. Disponible en: http://www.R-project.org/ 2015.
29. Menghi CI, Iuvaro FR, Dellacasa MA, Gatta CL. Investigación de parásitos intestinales en una comunidad aborigen de la provincia de Salta. Medicina (B. Aires) 67:705-708, 2007.
30. Milano AMF, Oscherov EB, Palladino AC, Bar AR. Enteroparasitosis infantil en un área urbana del nordeste argentino. Medicina (B. Aires) 67:238-242, 2007.
31. Dib J, Oquilla J, Lazarte SG, González SN. Parasitic prevalence in a suburban school of Famaillá, Tucumán, Argentina. ISRN Microbiol 2012:1-4, 2012.
32. Garraza M, Zonta ML, Oyhenart EE, Navone GT. Estado nutricional, composición corporal y enteroparasitosis en escolares del departamento de San Rafael, Mendoza, Argentina. Nutr Clin Diet Hosp 34(1):31-40, 2014.
33. Pullan RL, Brooker SJ. The global limits and population at risk of soil-transmitted helminth infections in 2010. Parasites Vectors 5:81, 2010.
34. Thompson RA. Giardiasis as a re-emerging infectious disease and its zoonotic potential. Int J Parasitol 30:1259-1267, 2000.
35. Belleza MLB, Cadacio JLC, Borja MP, Solon JAA, Padilla MA, Tongol-Rivera PN, et al. Epidemiologic study of Blastocystis infection in an urban community in the Philippines. J Environ Public Health 2015:894297, 2015.
36. Faria CP, Zanini GM, Dias GS, da Silva S, de Freitas MB, Almendra R, et al. Geospatial distribution of intestinal parasitic infections in Rio de Janeiro (Brazil) and its association with social determinants. PLoS Negl Trop Dis 11(3):e0005445, 2017.
37. Zonta ML, Bergel ML, Cociancic P, Gamboa MI, Garraza M, Cesani MF, et al. Enteroparasitosis en niños de Villaguay, Entre Ríos: un estudio integrado al estado nutricional y al ambiente. Rev Arg Parasitol 1(2):86-109, 2013.
38. Cazorla-Perfetti D. Aspectos relevantes de la enterobiosis humana, Revisión crítica. Saber 26:221-242, 2014.
39. Cociancic P, Zonta ML, Navone GT. A cross-sectional study of intestinal parasitoses in dogs and children of the periurban area of La Plata (Buenos Aires, Argentina): zoonotic importance and implications in public health. Zoonoses Public Health 65:e44-e53, 2018.
40. Forson AO, Arthur I, Ayeh-Kumi PF. The role of family size, employment and education of parents in the prevalence of intestinal parasitic infections in school children in Accra. PLoS One 13(2):e0192303, 2018.
41. Freeman MC, Ogden S, Jacobson J, Abbott D, Addiss DG, Amnie AG, et al. Integration of water, sanitation, and hygiene for the prevention and control of neglected tropical diseases: a rationale for inter-sectoral collaboration. PLoS Negl Trop Dis 7(9):e2439, 2013.
42. Coffeng LE, Vaz Nery S, Gray DJ, Bakker R, de Vlas SJ, Clements ACA. Predicted short and long-term impact of deworming and water, hygiene, and sanitation on transmission of soil-transmitted helminths. PLoS Neglect Trop D 12(12):e000675, 2018.
|
|