 Resumen
Objetivo: Analizar la evolución de los pacientes con un infarto criptogénico (IC) tras un año de seguimiento. Método: De nuestro registro prospectivo de ictus, durante un período de 4 años, identificamos 121 pacientes consecutivos con un IC. Se recogieron datos de recurrencia del ictus, eventos cardiovasculares y otras incidencias tras un año de seguimiento. Analizamos los datos de nuestro estudio y se correlacionan con datos de revisión bibliográfica. Resultados: Edad media: 70.6 años, 53.7% de varones. La arteria cerebral media (ACM) fue el territorio más afectado (52 casos), 70% de ellos con afección cortical. Ningún paciente falleció durante el ingreso. Durante el período de seguimiento, se detectó fibrilación auricular (FA) en 7 pacientes (6.54%), su edad media fue 75 años y en cinco de ellos el IC había sido en el territorio de la ACM (cuatro superficiales y uno profundo). Tres pacientes (2.76%) sufrieron una recurrencia del ictus isquémico, en las semanas 15, 16 y 44 después del IC. En los tres casos el ictus fue nuevamente considerado criptogénico. Dos pacientes sufrieron un infarto agudo de miocardio y cuatro fallecieron (infarto de miocardio, neoplasia de esófago, neumonía y muerte súbita). Conclusión: En nuestra serie, la tasa de recurrencia y de episodios cardiovasculares en el primer año tras un IC es baja. Un 11% de los pacientes con un IC en el territorio cortical de la ACM presentaron FA en el año siguiente, por lo que detectamos un subgrupo de IC tributarios de estudios cardiológicos más extensos.
Resumen
Objetivo: Analizar la evolución de los pacientes con un infarto criptogénico (IC) tras un año de seguimiento. Método: De nuestro registro prospectivo de ictus, durante un período de 4 años, identificamos 121 pacientes consecutivos con un IC. Se recogieron datos de recurrencia del ictus, eventos cardiovasculares y otras incidencias tras un año de seguimiento. Analizamos los datos de nuestro estudio y se correlacionan con datos de revisión bibliográfica. Resultados: Edad media: 70.6 años, 53.7% de varones. La arteria cerebral media (ACM) fue el territorio más afectado (52 casos), 70% de ellos con afección cortical. Ningún paciente falleció durante el ingreso. Durante el período de seguimiento, se detectó fibrilación auricular (FA) en 7 pacientes (6.54%), su edad media fue 75 años y en cinco de ellos el IC había sido en el territorio de la ACM (cuatro superficiales y uno profundo). Tres pacientes (2.76%) sufrieron una recurrencia del ictus isquémico, en las semanas 15, 16 y 44 después del IC. En los tres casos el ictus fue nuevamente considerado criptogénico. Dos pacientes sufrieron un infarto agudo de miocardio y cuatro fallecieron (infarto de miocardio, neoplasia de esófago, neumonía y muerte súbita). Conclusión: En nuestra serie, la tasa de recurrencia y de episodios cardiovasculares en el primer año tras un IC es baja. Un 11% de los pacientes con un IC en el territorio cortical de la ACM presentaron FA en el año siguiente, por lo que detectamos un subgrupo de IC tributarios de estudios cardiológicos más extensos.
 Palabras clave
ictus, infarto criptogénico, recurrencia, fibrilación auricular
Palabras clave
ictus, infarto criptogénico, recurrencia, fibrilación auricular
 Abstract
Abstract
Objective: To analyze the outcome of patients with cryptogenic infarct (CI) after a follow-up period of 1 year. Methods: We identified 121 consecutive patients with a CI in our prospective registry of stroke during a 4-year period. They were followed up for 1 year and we registered stroke recurrence, cardiovascular events and other events. We analyzed data from our study and we correlated it with data from literature review. Results: Mean age was 70.6 years-old and 53% were male. Middle cerebral artery (MCA) was the most affected territory (52 cases); seventy percent of those patients showed cortical involvement. None of the patients died during admission. During 1-year period, atrial fibrillation (AF) was detected in 7 patients (6.54%), their mean age was 75 years-old, in 5 of them the CI was in MCA territory (4 with cortical involvement, only one with deep infarction). Three patients (2.76%) suffered a recurrent ischemic stroke, in weeks 15, 16 and 44 after the CI. In all 3 cases the infarct was also considered cryptogenic. Two patients suffered a myocardial infarction and 4 died during the follow-up period. Conclusion: In our series, rate of stroke recurrence and cardiovascular events after a CI was low. An 11% of patients with a CI involving cortical MCA territory developed FA during the following year, so this subgroup of patients might benefit from a more complete cardiologic study.
 Key words
Key words
stroke, cyptogenic infarct, recurrence, atrial fibrillation
Artículo completo
DETALLAN EL SEGUIMIENTO PROLONGADO DE PACIENTES CON ICTUS ISQUEMICOS CRIPTOGENICOS
(especial para SIIC © Derechos reservados)
Introducción
De acuerdo con los criterios TOAST1 para la clasificación de los ictus isquémicos, un 9%-38% de los infartos cerebrales son de causa desconocida.2-12 Este último grupo incluye los que tienen más de una posible causa (habitualmente la asociación de origen cardioembólico y ateromatosis de grandes vasos), aquellos cuyo estudio ha sido incompleto y aquellos a los que no se les ha encontrado una causa a pesar de haberse realizado un estudio etiológico completo.
La frontera para poder afirmar que el estudio etiológico de un ictus isquémico ha sido completo no está bien delimitada y dependerá de varios factores. En principio, debe haberse estudiado el parénquima cerebral con una prueba de neuroimagen que ponga de manifiesto la localización y tamaño del infarto, así como un estudio neurovascular y cardiológico, la extensión de los cuales dependerá del criterio del médico responsable.13 Por ejemplo, es poco común en la práctica clínica diaria la realización de técnicas cruentas o molestas para pacientes mayores o con una mala situación funcional. En cambio, hay acuerdo para considerar que en un individuo joven debe realizarse un estudio más extenso que en pacientes de edad avanzada, ya que el perfil etiológico es distinto.
Hasta la fecha, diversos estudios han analizado el índice de recurrencia de eventos cerebrovasculares en los diferentes subtipos de ictus. En los infartos de causa indeterminada se sitúa entre el 7%-30% el primer año, habitualmente es menos frecuente que en los aterotrombóticos y cardioembólicos, pero más que en los lacunares.5-7,10,14-19 De todas formas, hay que considerar que el perfil del paciente con infarto criptogénico (IC) puede ser muy diverso, incluyendo el infarto de pequeño tamaño pero que no puede ser considerado estrictamente lacunar, así como aquel con sospecha de mecanismo embólico pero en el que no se detecta enfermedad cardíaca. Habitualmente, el tratamiento de elección para la prevención secundaria es la antiagregación plaquetaria.
Recientemente, hemos publicado un estudio20 que se diseñó con el objetivo de realizar un seguimiento de aquellos pacientes diagnosticados de IC, centrado especialmente en la aparición de recurrencias cerebrovasculares y cardiovasculares, así como todas aquellas circunstancias que pudieran cambiar su clasificación etiológica. En el presente artículo pasamos a revisar los datos más relevantes del citado estudio y posteriormente actualizamos la discusión.
Metodología del estudio
En 2002 se inició el registro prospectivo de ictus en nuestro hospital, posteriormente adaptado al formato BADISEN (Base de Datos de Ictus de la Sociedad Española de Neurología). Dicho registro incluye datos de filiación; sociodemográficos; estado funcional previo; historial médico, con especial énfasis en los factores de riesgo vascular y antecedentes de ictus y otros eventos vasculares; datos clínicos y radiológicos del ictus actual; clasificación según la OCSP,21 escala canadiense y NIHSS al ingreso; exploraciones complementarias realizadas; tipo de ictus; territorio vascular en los isquémicos y topografía en los hemorrágicos; clasificación etiológica según los criterios de la SEN;22 evolución intrahospitalaria en forma de nuevos eventos cerebrovasculares deterioro neurológico (definido como un aumento de cuatro puntos o más en la escala NIH) o ambos; y al alta, escala canadiense, NIHSS, Rankin, tratamiento y destino. Desde febrero de 2002 a febrero de 2006, un total de 1 057 pacientes se incluyeron en dicho registro y representaron la población de estudio.
Para considerar un infarto como criptogénico con estudio completo y, por tanto, ser incluido en el análisis, se requería al menos una prueba de neuroimagen (en lo posible, resonancia magnética) más allá de las primeras 24 horas, un estudio neurovascular que incluyera troncos supraaórticos y las principales arterias intracraneales, y un estudio cardiológico, con al menos un electrocardiograma y un ecocardiograma (en caso de no tener realizado uno en los meses previos). En los casos de alta sospecha de un origen cardioembólico, se realizaban ECG seriados durante el ingreso y un ECG-Holter de 24 horas. A criterio del neurólogo responsable, y en función de la sospecha diagnóstica y edad del paciente, se ampliaba el estudio diagnóstico con técnicas menos utilizadas habitualmente en práctica clínica diaria, como arteriografía convencional, ecocardiograma transesofágico y estudio analítico más completo (inmunológico, estudio de trombofilia). El tratamiento administrado y recomendado al alta fue el que el neurólogo responsable del paciente consideró más adecuado en cada caso.
De los 1 057 ictus incluidos, un total de 802 fueron infartos cerebrales. De ellos, 220 (27.4%) fueron de causa desconocida, divididos de la siguiente manera: 46 por más de una causa, 57 por estudio insuficiente y 121 de causa desconocida con estudio considerado completo (15.1% del total de infartos). Sólo éstos últimos fueron considerados IC y han sido el grupo motivo de estudio.
A los pacientes con IC se les realizó un seguimiento durante un período de 12 meses, en visita a Consulta Externa siempre que fuera posible o, en su defecto, mediante entrevista telefónica. Se recogen durante este período datos de recurrencia de ictus (analizando los mismos parámetros que en el ictus inicial), episodios cardiovasculares, muerte y cualquier incidencia que motivara un posible cambio en el diagnóstico etiológico.
Resultados
Los datos generales de la serie se muestran en la Tabla 1. En total, se incluyeron 121 pacientes, 65 hombres (53.7%) y 56 mujeres, con una media de edad de 70.6 años. El factor de riesgo vascular más frecuente fue la hipertensión arterial (58.7%), seguido de la dislipidemia (40.5%), el tabaquismo (23.1%) y la diabetes mellitus (23.1%). Trece pacientes (10.7%) tenían antecedente de ictus: uno de ellos había sido considerado aterotrombótico de gran vaso, cinco de pequeños vasos, dos criptogénicos, en cuatro desconocíamos los datos y uno había sido un hematoma. Veintiún pacientes (17.4%) estaban en tratamiento antitrombótico, 17 con aspirina, 3 recibían clopidogrel y uno era tratado con acenocumarol (debido a un tromboembolismo pulmonar reciente). Además, un paciente tenía antecedente de endarterectomía carotídea.
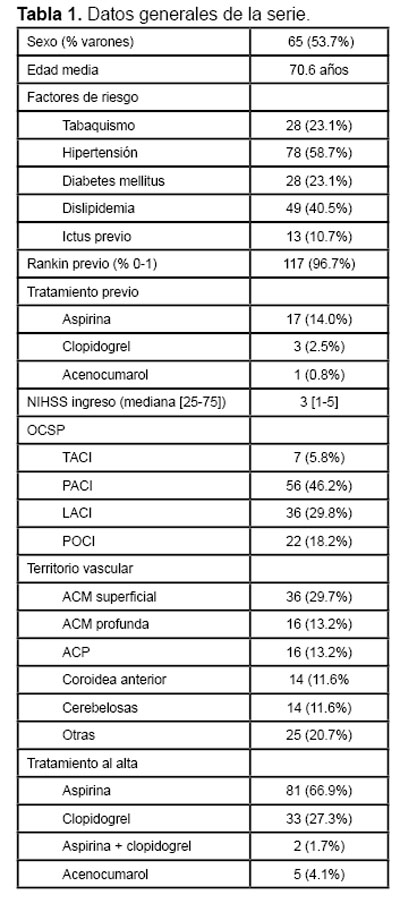
De acuerdo con la clasificación OCSP, 7 infartos (5.8%) fueron tipo TACI, 56 (46.2%) PACI, 36 (29.8%) LACI y 22 (18.2%) POCI. El territorio vascular más afectado fue la arteria cerebral media (ACM), con 52 casos (43.0%), 36 con afección cortical y 16 con afección exclusivamente subcortical, seguido de la arteria cerebral posterior (ACP) (13.2%) y de la coroidea anterior (11.6%).
En el estudio diagnóstico, se efectuó resonancia magnética nuclear (RMN) craneal a un 87.6% de pacientes, tomografía computarizada al resto, ecodoppler de troncos supraaórticos al 96.7%, Doppler transcraneal al 94.2%, angiografía por RMN a un 23.1%, angiografía por sustracción digital a 3.3%, ecocardiograma transtorácico a un 90.1%, transesofágico a un 4.9% y ECG-Holter de 24 horas a un 62.8%. A todos los pacientes se les efectuó una extracción analítica (hemograma, bioquímica y estudios de coagulación) y un electrocardiograma.
La mediana de la NIHSS al ingreso fue de 3, y al alta de 1. Durante el ingreso ningún paciente sufrió recurrencia en forma de AIT, nuevo infarto o hemorragia, pero cuatro presentaron deterioro neurológico.
Al alta, 79 pacientes (65.3%) tenían un Rankin igual o inferior a 2, y 85 (70.2%) pudieron ser dados de alta a su domicilio. Como prevención secundaria, 116 pacientes (95.9%) recibieron tratamiento antiagregante, 81 con aspirina, 33 con clopidogrel, y dos, la combinación de ambos. Los cinco restantes fueron tratados con anticoagulantes orales.
En lo que respecta a la evaluación extrahospitalaria y el seguimiento a largo plazo, no se pudo completar el año de seguimiento en 14 pacientes (11.5%), dado que no acudieron a los controles ni se les pudo localizar por teléfono.
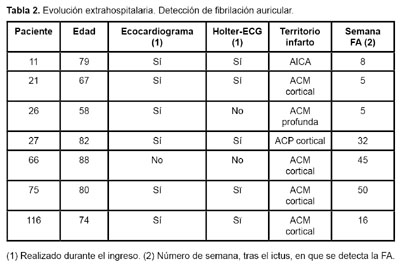
Durante el período de seguimiento se detectó fibrilación auricular (FA) en siete pacientes, en las semanas 5 (dos de ellos), 8, 16, 32, 45 y 50 tras el ictus (Tabla 2). De todos ellos, a cinco se les había realizado un ECG-Holter de 24 horas durante el ingreso, que en ningún caso había mostrado arritmias. Cuatro de los siete pacientes superaban los 75 años, y seis, los 65. El infarto cerebral había sido en el territorio de la ACM en cinco de ellos (cuatro con afección superficial), ACP en uno y cerebelosa anteroinferior (ACAI) en el restante. Por tanto, 4 de los 36 pacientes (11.1%) con un infarto superficial de la ACM presentaron FA durante los 12 meses siguientes.
Se produjo un nuevo ictus isquémico en tres pacientes, en las semanas 15, 16 y 44. Dos de ellos habían sufrido el primer infarto en la ACM y el tercero en la ACP, todos ellos con afección superficial. En todos los casos el infarto fue considerado nuevamente criptogénico, ya que no coincidió con ninguno de los que se detectó la FA. Sólo uno de los tres repitió el ictus en el mismo territorio (ACM cortical). Los tres pacientes eran fumadores, dos de ellos hipertensos y uno dislipidémico, y los tres habían recibido aspirina como tratamiento preventivo tras el primer ictus. Dos pacientes sufrieron un infarto de miocardio (IAM), en las semanas 5 y 16. Cuatro pacientes fallecieron, a causa de un IAM (semana 5), muerte súbita (semana 8), neoplasia esofágica (semana 9) y neumonía (semana 13).
Discusión
El estudio analiza las características de los IC y sus circunstancias tras un año de seguimiento. La frecuencia de infartos de causa desconocida de nuestra serie se situó dentro de los márgenes habituales, tanto si incluimos los tres subtipos (doble causa, estudio incompleto y estudio completo) como si limitamos el análisis a aquellos IC tras estudio completo. En el primer caso, el porcentaje varía entre el 10% y el 36% según los autores2-5,7-10,12,19 (27.4% en nuestra serie). Menos son los estudios que han analizado la frecuencia específica de los IC tras el examen completo, situándose entre el 6% y el 20%4,7,11 (15.1% en nuestra serie).
Como se puede observar de los datos anteriores, las cifras de frecuencia de IC son muy variables. Ello es debido a varios factores: en primer lugar, como se ha comentado, los criterios de inclusión son distintos de un estudio a otro, ya que el límite para considerar un estudio etiológico como completo no es nítido y a menudo se deja a criterio del neurólogo responsable. Por otra parte, los criterios para que un ictus sea catalogado en una u otra etiología están sometidos actualmente a revisión. Así, por ejemplo, algunos autores han sugerido que los infartos subcorticales mayores de 15 mm, considerados criptogénicos, tienen una fisiopatología similar y, por tanto, la enfermedad de pequeños vasos está subdiagnosticada,23,24 actualmente la etiología del infarto lacunar es un concepto en revisión.25 Por otra parte, recientemente se ha propuesto un nuevo sistema de clasificación etiológica para el ictus isquémico, la clasificación A-S-C-O,26 que otorga un valor de 1 a 3 para cada subtipo, en función de criterios de probabilidad, de manera que se mejora la precisión diagnóstica, disminuyendo así el porcentaje de infartos criptogénicos.
La tasa de recurrencia (2.8% de los que pudo efectuarse seguimiento a los 12 meses) fue baja en comparación con la referida en la literatura, que se cifra en el 5.1%-13%.5,6,10,11,14,18,27,28 La pérdida de un 11% de pacientes en el seguimiento podría haber influido en esta cifra, ya que alguno de estos pacientes podría haber sufrido una recurrencia. Por otra parte, en la clasificación etiológica fuimos estrictos a la hora de considerar como de pequeños vasos únicamente los infartos profundos de diámetro inferior a 15 mm, a diferencia de lo que han sugerido algunos autores (como se ha discutido previamente). Por lo tanto, los infartos subcorticales de diámetro superior a 15 mm fueron considerados criptogénicos si no se hallaba otra causa. Dado que es posible que muchos de ellos tuvieran enfermedad de pequeños vasos subyacente, habitualmente de buen pronóstico, ello puede haber contribuido al bajo índice de recurrencia. En cualquier caso, nuestros datos han confirmado que la tasa de recurrencia de los infartos criptogénicos es baja, especialmente en comparación con los aterotrombóticos y cardioembólicos.
A nuestro juicio, el aspecto más interesante de los resultados fue la detección de FA en siete pacientes durante el año posterior al IC, este dato es aun más llamativo (11%) si lo limitamos a los infartos de la ACM con afección cortical. Aunque el estudio no fue diseñado específicamente para estudiar la incidencia de arritmias paroxísticas en estos pacientes, sí permite deducir que en los infartos corticales en los que se sospeche un mecanismo embólico y no se haya detectado la causa, especialmente en personas de edad avanzada, debe investigarse la posible presencia de una FA paroxística. En los últimos años se han propuesto diversos métodos para detectarla. La realización de ECG-Holter seriados puede ser de gran utilidad, ya que el rendimiento de dicha prueba aumenta con el tiempo de monitorización.29 La monitorización electrocardiográfica transtelefónica también aumenta la tasa de detección de fibrilación auricular paroxística.30 Por último, la monitorización cardíaca de eventos durante 30 días puede llegar a detectar fibrilación auricular en el 20% de los pacientes con un infarto cerebral criptogénico.31
Reconocemos que en nuestro estudio la cifra de ecocardiogramas transesofágicos (ETE) realizados puede considerarse baja tratándose de una serie de IC. El ETE es una prueba que permite diagnosticar la presencia de un foramen oval permeable,32 con aneurisma del septum o sin él, ateromatosis aórtica,33 además de ser más preciso en el estudio global que la ecocardiografía transtorácica. El papel del foramen oval permeable en la etiopatogenia del ictus está actualmente en discusión, así como su tratamiento.34 Respecto de la ateromatosis aórtica, y aunque el mecanismo patogénico también ha sido motivo de discusión, así como su tratamiento,35 sí se conoce que la presencia de placas complicadas incrementa significativamente el riesgo de ictus. En la serie de Pujadas y col.,28 se realizó un ETE a todos los pacientes que presentaron recurrencia tras un IC, en el 82.4% se demostró la presencia de placas complejas, y los autores concluyeron que se trata de una exploración poco utilizada. Más recientemente, se ha postulado que incluso las placas complejas en la aorta descendente proximal podrían desempeñar un papel en la etología de los ictus criptogénicos, debido a la existencia de un flujo diastólico retrógrado.36 En los casos en que nadie discute la necesidad de un ETE es en el estudio etiológico de un infarto cerebral en pacientes menores de 55 años, donde el rendimiento supera el 50%.37 De los once pacientes (9%) menores de 55 años de nuestra serie, sólo a dos no se les realizó ETE, en un caso por tratarse de un individuo extranjero que regresó a su país, y en el otro porque no dio su consentimiento.
También puede considerarse una limitación de nuestro estudio la heterogeneidad de la serie, con un perfil topográfico distinto en muchos pacientes, así como en sus exploraciones complementarias. La explicación a este hecho es que se trató de un estudio realizado en la práctica clínica diaria, y a partir de una serie de pacientes consecutivos y no seleccionados con el fin, precisamente, de detectar si existía un perfil de pacientes con pronóstico distinto, como así fue.
En resumen, en nuestra serie el pronóstico de los infartos criptogénicos fue bueno, con una baja tasa de recurrencia; detectamos un subgrupo de pacientes con infartos corticales en los que debe apurarse la búsqueda de una cardiopatía embolígena, y valorarse la monitorización electrocardiográfica de larga duración, incluso después del alta hospitalaria.
|
 Bibliografía del artículo
Bibliografía del artículo
1. Adams HP, Bendixen BH, Kappelle LJ y col. and the TOAST Investigators. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. Stroke 24:35-41, 1993.
2. Moulin T, Tatu L, Crépin-Leblond T, Chavot D, Bergès S, Rumbach L. The Besançon Stroke Registry: An acute stroke registry of 2.500 consecutive patients. Eur Neurol 38:10-20, 1997.
3. Martí-Vilalta JL, Arboix A. The Barcelona Stroke Registry. Eur Neurol 41:135-142, 1999.
4. Vemmos KN, Takis CE, Georgilis K, y col. The Athens Stroke Registry: Results of a five-year hospital-based study. Cerebrovascular Dis 10:133-141, 2000.
5. Petty GW, Brown Jr RD, Whisnant JP, Sicks JD, O'Fallon WM, Wiebers DO. Ischemic stroke subtypes. A population-based study of functional outcome, survival, and recurrence. Stroke 31:1062-1068, 2000.
6. Kolominsky-Rabas PL, Weber M, Gefeller O, Neundoerfer B, Heuschmann PU. Epidemiology of ischemic stroke subtypes according to TOAST criteria. Incidence, recurrence, and long-term survival in ischemic stroke subtypes: a population-based study. Stroke 32:2735-2740, 2001.
7. Bang OY, Lee PH, Joo SY, Lee JS, Joo IS, Huh K. Frequency and mechanisms of stroke recurrences after cryptogenic stroke. Ann Neurol 54:227-234, 2003.
8. Saposnik G, Del Brutto OH, for the Iberoamerican Society of Cerebrovascular Diseases. Stroke in South America. A systematic review of incidence, prevalence and stroke subtypes. Stroke 34:2103-2108, 2003.
9. Lovett JK, Coull AJ, Rothwell PM. Early risk of recurrence by subtype of ischemic stroke in population-based incidence studies. Neurology 62:569-573, 2004.
10. Soda T, Nakayasu H, Maeda M, y col. Stroke recurrence within the first year following cerebral infarction - Tottori University Lacunar Infarction Prognosis Study (TULIPS). Acta Neurol Scand 110:343-349, 2004.
11. Santamarina E, Rubiera M, Molina CA, y col. Pronóstico funcional tras un año de seguimiento en pacientes con infarto cerebral de causa desconocida y foramen oval permeable. Med Clin 124:561-565, 2005.
12. Arboix A, Cendrós V, Besa M, y col. Trends in risk factors, stroke subtypes and outcome. Nineteen-year data from the Sagrat Cor Hospital of Barcelona Stroke Registry. Cerebrovasc Dis 26:509-516, 2008.
13. Ay H, Benner T, Arsava EM, y col. A computerized algorithm for etiologic classification of ischemic stroke: The causative classification of Stroke System. Stroke 38:2979-2984, 2007.
14. Sacco RL, Ellenberg JH, Mohr JP, y col. Infarcts of undetermined cause: The NINCDS Stroke Data Bank. Ann Neurol 25:382-390, 1989.
15. Anderson CG, Jamrozik KD, Broadhurst RJ, Stewart-Wynne EG. Predicting survival for 1 year among different subtypes of stroke. Results from the Perth Community Stroke Study. Stroke 25:1935-1944, 1994.
16. Hankey GJ. Long-term outcome after ischaemic stroke/transient ischaemic attack. Cerebrovasc Dis 16(Suppl.1):14-19, 2003.
17. Hardie K, Jamrozik K, Hankey GJ, Broadhurst RJ. Trends in five-year survival and risk of recurrent stroke after first-ever stroke in the Perth Community Stroke Study. Cerebrovasc Dis 19:179-185, 2005.
18. Kaplan RC, Tirchwell DL, Longstreth Jr WT, Manolio TA, Heckbert SR, Lefkowitz D. Vascular events, mortality, and preventive therapy following ischemic stroke in the elderly. Neurology 65:835-842, 2005.
19. Xu G, Liu X, Wu W, Zhang R, Yin Q. Recurrence after ischemic stroke in chinese patients: impact of uncontrolled modifiable risk factors. Cerebrovasc Dis 23:117-120, 2007.
20. Palomeras E, Fossas P, Cano AT, Sanz P. Infartos criptogénicos. Estudio de un año de seguimiento. Neurología 24:304-308, 2009.
21. Bamford J, Sandercock P, Dennis M, Burn J, Warlow C. Classification and natural history of clinically identifiable subtypes of cerebral infarction. Lancet 337:1521-1526, 1991.
22. Arboix A, Díaz J, Pérez-Sempere A, Álvarez Sabin J, en representación del Comité ad hoc del Grupo de Estudio de Enfermedades Cerebrovasculares de la SEN. Ictus: tipos etiológicos y criterios diagnósticos. Neurología 17(Suppl.3):3-12, 2002.
23. Kang DW, Chalela JA, Ezzeddine MA, Warach S. Association of ischemic lesion patterns on early diffusion-weighted imaging with TOAST stroke subtypes. Arch Neurol 60:1730-1734, 2003.
24. Cho AH, Kang DW, Kwon SU, Kim JS. Is 15 mm size criterion for lacunar infarction still valid? A study on strictly subcortical middle cerebral artery territory infarction using diffusion-weighted MRI. Cerebrovasc Dis 23:14-19, 2007.
25. Arboix A, Martí-Vilalta JL. New concepts in lacunar stroke etiology: the constellation of small-vessel arterial disease. Cerebrovasc Dis 17 (Suppl.1):58-62, 2004.
26. Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Hennerici MG. New approach to stroke subrtyping: the A-S-C-O (phenotypic) classification of stroke. Cerebrovasc Dis 27:502-508, 2009.
27. Wong KS, Li H. Long-term mortality and recurrent stroke risk among chinese stroke patients with predominant intracranial atherosclerosis. Stroke 34:2361-2366, 2003.
28. Pujadas R, Arboix A, Anguera N, Oliveres M, Massons J, Comes E. Papel de las placas complejas de ateroma aórtico en la recurrencia del infarto cerebral de etiología incierta. Rev Esp Cardiol 58:34-40, 2005.
29. Liao J, Khalid Z, Scallan C, Morillo C, O'Donnell M. Noninvasive cardiac monitoring for detecting paroxysmal atrial fibrillation or flutter after acute ischemic stroke. A systematic review. Stroke 38:2935-2940, 2007.
30. Gaillard N, Deltour S, Vilotijevic B, y col. Detection of paroxysmal atrial fibrillation with transtelephonic EKG in TIA or stroke patients. Neurology 74:1666-1670, 2010.
31. Elijovich L, Josephson SA, Fung GL, Smith WS. Intermittent atrial fibrillation may account for a large proportion of otherwise cryptogenic stroke: a study of 30-day cardiac event monitors. J Stroke Cerebrovasc Dis 18:185-189, 2009.
32. Carod-Artal FJ, Vilela Nunes S, Portugal D. Trombofilia y foramen oval permeable en pacientes jóvenes afectos de ictus isquémico. Neurología 21:710-716, 2006.
33. Castellanos M, Serena J, Segura T, Pérez-Ayuso MJ, Silva Y, Dávalos A. Atherosclerotic aortic arch plaques in cryptogenic stroke: a microembolic signal monitoring study. Eur Neurol 45:145-150, 2001.
34. Serena J. Foramen oval permeable: ¿cómo y de qué es factor de riesgo? Neurología 21:689-694, 2006.
35. Molina CA, Santamarina E, Alvarz-Sabín J. Cryptogenic stroke, aortic arch atheroma and patent forman ovale. Cerebrovasc Dis 24(Suppl.1):84-88, 2007.
36. Harloff A, Simon J, Brendecke S y col. Complex plaques in the proximal descending aorta: an underestimated embolic source of stroke. Stroke 41:1145-1150, 2010.
37. Rus Mansilla C, Mesa Rubio D, Suarez de Lezo Cruz Conde J, Rodríguez Almodovar A, Duran Torralbo C, Delgado Ortega M. Utilidad del ecocardiograma transesofágico en pacientes jóvenes con ictus de origen desconocido y bajo riesgo cardiovascular. Med Clin 130:241-245, 2008.
Artículos publicados por el autor
(selección):
Ernest Palomeras, Virginia Casado Epidemiology and risk factors of cerebral ischemia and ischemic heart diseases: similarities and differences Current Cardiology Reviews 6:138-149, 2010
Ernest Palomeras, Pilar Fossas, Antonio Cano, Pilar Sanz Infartos criptogénicos. Estudio de un año de seguimiento Neurologia 24:304-308, 2009
Ernest Palomeras, Pilar Fossas, Antonio Cano, Pilar Sanz, Misericordia Floriach Anterior choroidal artery infarction. A clinical, etiologic and prognostic study Acta Neurologica Scandinavica 118:42-47, 2008
Ernest Palomeras, Pilar Fossas, Manuel Quintana, Rosa Monteis, Marisa Sebastián, Carme Fábregas, Anna Ciurana, Marc Ribó, Antonio Cano, Pilar Sanz, Misericordia Floriach, Jose. Alvarez-Sabín Emergency perception and other variables associated to extra-hospital delay in stroke patients in the Maresme region (Spain) European Journal of Neurology 15:329-335, 2008
Ernest Palomeras, Pilar Fossas, Manuel Quintana, Rosa Monteis, Marisa Sebastián, Carme Fábregas, Anna Ciurana, Marc Ribó, Antonio Cano, Pilar Sanz, Misericordia Floriach, Jose. Alvarez-Sabín Reconocimiento de los síntomas del ictus y respuesta frente a los mismos en la población Neurologia 22:434-440, 2007
Ernest Palomeras, Adrià Arboix Conocimiento de la enfermedad vascular cerebral en la población Neurologia Supl:8-12, 2005
Ernest Palomeras, Pilar Fossas, Antonio Cano, Pilar Sanz Estenosis intracraneales. Estudio y seguimiento de 38 pacientes Neurologia 19:254-259, 2004
Ernest Palomeras, Antonio Cano, Pilar Sanz, Teresa Abellán, Pilar Fossas Validación del doppler transcraneal en Mataró Revista de Neurología 33:96-97, 2001
Ernest Palomeras, Pilar Sanz, Antonio Cano, Pilar Fossas Dystonia in a patient treated with propranolol and gabapentin Archives of Neurology 57:570-571, 2000
Ernest Palomeras, Jaume Roquer Ictus y fibrilación auricular Neurologia 15:51-57, 2000
|
|