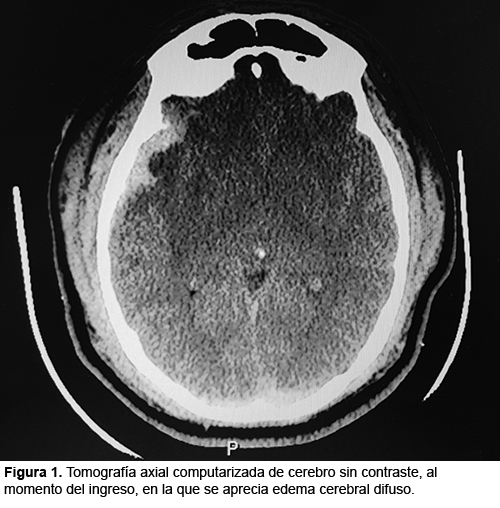
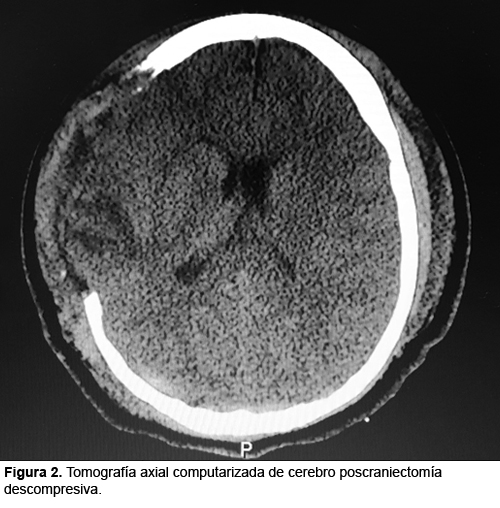
HIPERACTIVIDAD SIMPATICA PAROXISTICA: PRESENTACION DE UN CASO
La hiperactividad simpática paroxística es una enfermedad que frecuentemente es secundaria a un traumatismo craneoencefálico, y se presenta generalmente en personas en edad productiva. Esta afección es potencialmente mortal, pero, reconocida a tiempo y descartando complicaciones, un tratamiento temprano y oportuno puede salvar la vida de quienes la padecen.
Institución del autor
Clínica Privada Independencia, Munro - Vicente López, Argentina
Coautores
Damián Rutolo* Jhair Martínez Obando* Álvaro Ramírez Toncel* Vidal Tumiri Lescano*
Médico, Clínica Privada Independencia*
Primera edición en siicsalud
13 de noviembre, 2017