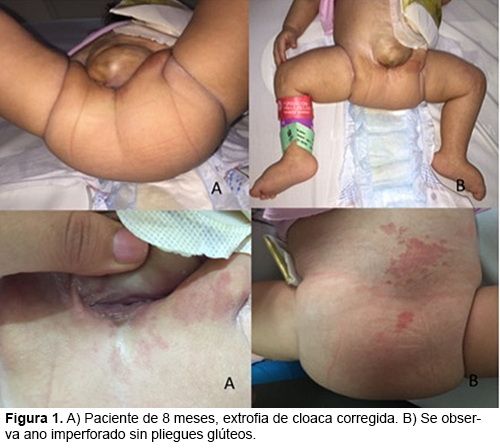
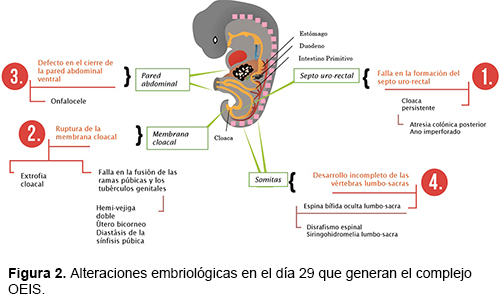
INVESTIGACION DE UN CASO DE EXTROFIA DE LA CLOACA PRODUCTO DE EMBARAZO TRIGEMELAR
El manejo actual de la secuencia de extrofia de la cloaca se basa en un abordaje multidisciplinario, con metas enfocadas en optimizar las funciones del paciente, su desarrollo psicosocial y su calidad de vida. Del mismo modo, el diagnóstico prenatal ha permitido una mejor preparación para recibir el nacimiento da la oportunidad para una adecuada educación y asesoramiento a los padres.
Institución del autor
Universidad ICESI, Cali, Colombia
Coautores
Andrés Felipe Ramirez* Sara Vanegas** Diana Ramírez** Raúl Astudillo*
Médico, Universidad ICESI, Cali, Colombia*
Médica, Universidad ICESI, Cali, Colombia**
Primera edición en siicsalud
12 de diciembre, 2017