INFECCION DISEMINADA POR MYCOBACTERIUM SZULGAI CON COMPROMISO PULMONAR Y GANGLIONAR EN UN PACIENTE CON SIDA
Se presenta el primer caso de micobacteriosis por M. szulgai en un paciente cubano con sida, el cual presentó infección respiratoria con diseminación ganglionar cervical.
Institución del autor
Instituto de Medicina Tropical ¨Pedro Kourí", La Habana, Cuba
Primera edición en siicsalud
16 de abril, 2012
Introducción
Las micobacterias no tuberculosas (MNT), atípicas, ambientales u oportunistas están ampliamente distribuidas en el medio ambiente, principalmente en el agua y la tierra. La transmisión de la infección de persona a persona no está comprobada. El mecanismo de transmisión más aceptado es el de la aerosolización del microorganismo del medio ambiente en la afección respiratoria, y el de su ingestión por vía digestiva en el caso de las linfadenitis e infecciones diseminadas en pacientes generalmente con algún tipo de inmunodeficiencia, incluidos aquellos con el síndrome de inmunodeficiencia adquirida (sida).1,2 Estas micobacterias, que hasta la aparición del sida tuvieron relativamente poca importancia en patología humana como causantes de cuadros clínicos, constituyen no obstante en la actualidad un nuevo capítulo en las enfermedades infecciosas, por lo que se clasifican como patógenos emergentes.2,3
Mycobacterium szulgai es una MNT descrita como nueva especie patógena para el hombre en 1972 por Marks y colaboradores. El aislamiento de esta especie, una de las 115 descritas en el género Mycobacterium, no es frecuente en los seres humanos. M. szulgai es responsable de menos del 1 % de todos los aislamientos de MNT en los seres humanos; por esta razón, su aislamiento siempre se considera como agente patógeno.4-6 La presentación clínica de la enfermedad pulmonar producida por este microorganismo suele ser muy similar a la tuberculosis; el diagnóstico se presumirá cuando el tratamiento antituberculoso inicial no produzca la respuesta esperada. Asimismo, también se aísla ocasionalmente en afecciones osteoarticulares, compromiso cutáneo o ganglionar.7-11
El objetivo de este estudio fue describir el primer caso en nuestro país de infección respiratoria con diseminación ganglionar por M. szulgai en un paciente cubano con sida.
Caso clínico
Paciente masculino, de 31 años, infectado por el virus de inmunodeficiencia humana (VIH), diagnosticado en diciembre de 2007. En abril de 2010 acudió a nuestro centro hospitalario con astenia, anorexia, pérdida de peso, fiebre, tos productiva y disnea de más de 14 días de evolución. Al examen clínico se encontraron múltiples lesiones con aspecto de moluscos contagiosos en cara, tronco y miembros; además, presentaba lesiones eritematoescamosas de bordes definidos en manos (palmas y dorso), axilas y regiones inguinales. La auscultación pulmonar fue negativa, y el estado general, satisfactorio. Se ingresó con diagnóstico de síndrome de desgaste y posible neumonía por Pneumocystis jirovecci (PJP), sin excluir la posibilidad de tuberculosis pulmonar. Los estudios de laboratorio mostraron: Hb 13.6 g/l, Hto 43%, leucocitos 3.7 x 109/l (segmentados 71%, linfocitos 19%, monocitos 6%, eosinófilos 4%), plaquetas 180 x 109/l, eritrosedimentación 60 mm/h, glucemia 5.7 mmol/l, deshidrogenasa láctica 238 U/l, creatinina 64 µmol/l, amilasa sérica 35 U/l, alanino aminotransferasa (TGP) 56 U/l, aspartato aminotransferasa (TGO) 47 U/l, CD4 1% con 7 células/µl, carga viral 68 964 copias/ml, leucocituria negativa, hemocultivos negativos. La radiografía de tórax y la ecografía abdominal fueron normales. Por medidas de bioseguridad el paciente fue puesto en régimen de aislamiento respiratorio. Los esputos bacteriológicos directos y los cultivos para bacilos ácido-alcohol resistentes (BAAR) resultaron negativos. Ante la presunción clínica de PJP, se lo trató con cotrimoxazol (sulfametoxazol 400 mg + trimetoprima 80 mg) (2 ampollas cada 6 horas), ácido fólico 5 mg/día, hidrocortisona 100 mg/8 h, y oxigenoterapia. El tratamiento antibiótico se mantuvo por 10 días. A los siete días de ingresado se añadió al tratamiento, terapia antirretroviral con zidovudina, lamivudina y nevirapina, y profilaxis antituberculosa con isoniacida 300 mg/día, por el bajo conteo de CD4. A los pocos días apareció anemia ligera (9.9 g/l de Hb), por lo que se cambió la zidovudina por estavudina. Finalmente, egresó asintomático, en franca recuperación general. En los meses subsiguientes se mantuvo asintomático pero con mala adhesión a la terapia antirretroviral.
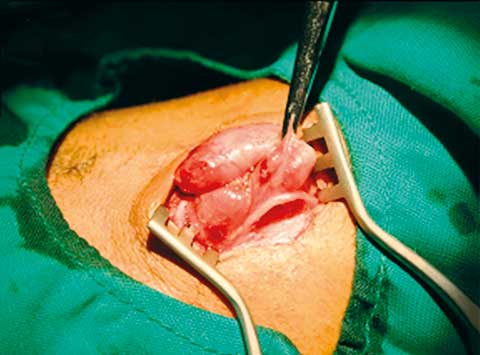
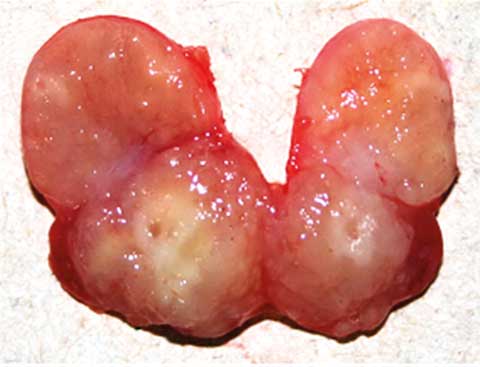
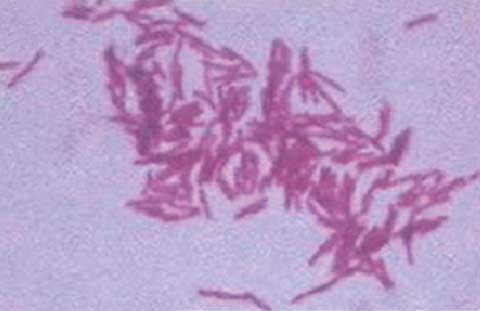
En septiembre de 2010 ingresa nuevamente en nuestra institución hospitalaria; esta vez el paciente refería fiebre vespertina de hasta 39oC acompañada de escalofríos y sudoración, astenia y anorexia notorias, pero sin síntomas respiratorios. Al examen físico se encontró palidez cutáneo-mucosa, debilidad extrema que le dificultaba deambular sin foco neurológico, lesiones de molusco contagioso diseminadas, examen respiratorio negativo y presencia de adenopatías cervicales dolorosas y elásticas, más notorias en el lado izquierdo. Los estudios de laboratorio mostraron los siguientes resultados: Hb 5.9 g/l, leucocitos 7.0 x 109/l (segmentados 85%, linfocitos 10%, monocitos 5%), plaquetas 697 x 109/l, glucemia 3.3 mmol/l, creatinina 54 µmol/l, TGP 52 U/l, TGO 73 U/l, LDH 168 U/l, carga viral 120 000 copias/ml, y CD4 3% con 21 cél/µl (con 70% de leucocitos y 10% de linfocitos). La radiografía de tórax fue negativa, sin embargo, en la ecografía abdominal se encontró una ligera hepato-esplenomegalia y múltiples adenopatías retroperitoneales de hasta 3 cm de diámetro. Ante la presunción de linfoma o tuberculosis ganglionar se solicitaron estudios anatomopatológicos y de cultivo para BAAR. La biopsia del tejido ganglionar cervical se realizó quirúrgicamente; en ésta se encontraron múltiples adenopatías móviles y duras, con importante fibrosis en los tejidos vecinos (Figuras 1A y 1B). Además, se solicitó cultivo para BAAR de muestras de esputo; éstas fueron enviadas respectivamente al Laboratorios de Anatomía Patológica y al Laboratorio Nacional de Referencia de Tuberculosis y Micobacterias para descartar la presencia de BAAR. El examen histológico mostró linfadenitis granulomatosa, con presencia de BAAR; a partir de este diagnóstico se comenzó de inmediato tratamiento antituberculoso con Isoniacida 300 mg/día, rifampicina 600 mg/día, pirazinamida 1 500 mg/día, etambutol 750 mg/día, con evolución tórpida.
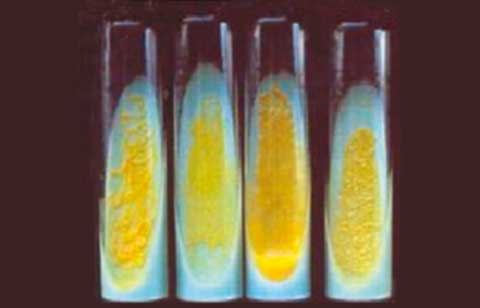
Las muestras para cultivo de BAAR fueron tratadas según las metodologías y técnicas establecidas para los Laboratorios de Micobacteriología.12,13 Para el cultivo se utilizó el medio Löwenstein-Jensen; las muestras fueron incubadas a 37ºC y las lecturas de los cultivos se realizaron semanalmente. A partir de las 3 a 4 semanas se observó la presencia de colonias pigmentadas de coloración amarillo-anaranjada, de crecimiento lento; la codificación de estos cultivos osciló entre 3 y 7 (Figuras 2A y 2B). Para confirmar la presencia de BAAR se realizó la tinción de Zielh-Neelsen a partir de las colonias. Para la clasificación e identificación de la cepa aislada se utilizó la prueba bioquímica establecida.14,15 La cepa micobacteriana aislada fue clasificada como perteneciente al Grupo II de Runyon (escotocromógeno) e identificada como M. szulgai. Para la confirmación diagnóstica se utilizó el análisis del patrón de las fracciones de ácidos micólicos micobacterianos por cromatografía en capa delgada; las fracciones obtenidas fueron: alfa-micolato, metoxi-micolato y ceto-micolato, además de la mancha perteneciente a los ésteres metílicos de ácidos grasos, patrón característico de M. szulgai.16,17
A partir de estos resultados se suspendió el tratamiento antituberculoso y se inició esquema terapéutico con rifampicina 600 mg/día, etambutol 750 mg/día, claritromicina 500 mg/día, por un año. El paciente comienza a evolucionar favorablemente, con notable mejoría de su estado general, respondiendo bien al tratamiento. El 8 de octubre de 2010 egresa clínicamente restablecido; se mantiene con seguimiento y control ambulatorio.
Discusión
En las últimas décadas, las enfermedades producidas por micobacterias, denominadas micobacteriosis, han constituido y constituyen uno de los capítulos más importantes de las enfermedades infecciosas que afectan a los seres humanos. A este grupo de patógenos pertenecen dos de las enfermedades más antiguas y devastadoras que han afectado al hombre a lo largo de toda su historia, la tuberculosis y la lepra, pero desde hace mas de 50 años comenzaron a describirse una serie de cuadros clínicos muy parecidos a la tuberculosis, pero producidos por otras especies de micobacterias. La importancia de estas infecciones, lejos de disminuir, continúa en claro aumento por diferentes razones. Existen más de 115 especies de micobacterias identificadas, de las que relativamente pocas producen compromiso pulmonar y, con menos frecuencia aún, compromiso ganglionar, como es el caso de M. szulgai que se presenta.18
La tuberculosis sigue siendo, al inicio de este nuevo milenio, la enfermedad infecciosa humana más importante que existe en el mundo. Esta vieja endemia, que acompaña a la especie humana desde hace milenios, no sólo puede ser considerada como la más terrible plaga que ha padecido la humanidad, sino que, aun hoy, se encuentra en el más absoluto descontrol epidemiológico, pudiendo observarse que las cifras de enfermos y fallecidos por esta causa siguen aumentando año tras año en todo el mundo.
Con respecto a las denominadas MNT, atípicas, ambientales u oportunistas, su reservorio homólogo puede ser el hombre enfermo, aunque la transmisión en los seres humanos no está comprobada, en tanto que el reservorio heterólogo son los animales domésticos, los invertebrados, los peces, los anfibios, los reptiles, las aves y los mamíferos, por lo que la transmisión puede realizarse por contacto y por consumo de carne, si bien las principales fuentes de infección son el suelo y el agua. Esta variabilidad de fuentes de infección precisamente es lo que dificulta el control epidemiológico.19-21 Durante muchos años,la descripción de las micobacteriosis era un hecho ocasional; la mayoría de los casos descritos se asociaban con pacientes con algún tipo de inmunodeficiencia, sujetos con neoplasias, receptores de trasplantes, terapia prolongada con corticoides, bronquiectasias, etc. Sin embargo, después de la aparición de la infección por el VIH, la incidencia de micobacteriosis ha ido en constante aumento, incluso en los países desarrollados, y aun en niños.22 Mycobacterium szulgai se incluye en el grupo de las micobacterias ambientales, por su aislamiento ocasional de aguas estancadas, por ejemplo de piscinas y acuarios, y su bajísimo impacto epidemiológico en seres humanos al encontrarse en menos del 1% de todos los casos diagnosticados de MNT y no conocerse casos de trasmisión de persona a persona.23-25 Pero, a diferencia de otras MNT, esta especie micobacteriana produce enfermedad clínica en seres humanos y también se le reconoce con cierta frecuencia en animales.26 Hasta 1998, sólo se habían publicado 38 casos clínicos diagnosticados, sobre todo asociados con estados de inmunodepresión por neoplasias malignas o terapia inmunodepresora, pero más recientemente la pandemia de sida ha aumentado la frecuencia de informes de MNT, pues ya se indicaron no sólo como patógenos pulmonares, sino también en infecciones extrapulmonares y diseminadas. Sin embargo, es raro el informe de M. szulgai con compromiso ganglionar y pulmonar, lo que confirma el diagnóstico de enfermedad diseminada.9-11,27-32
En Cuba, Ferrá y col. (1996) describieron la presencia de M. szulgai con una baja frecuencia de aislamientos; ya en estudios mas recientes realizados en nuestro laboratorio, no se informó aislamiento alguno de esta especie.33-34
Mycobacterium szulgai muestra susceptibilidad a la mayoría de los fármacos anti-tuberculosos convencionales, a quinolonas, macrólidos modernos y a la combinación de trimetroprima-sulfametoxazol y doxiciclina. No existen recomendaciones estándar de tratamiento, pero en la mayoría de los casos informados en el mundo se ha implementado tratamiento por uno a dos años con al menos tres fármacos, típicamente isoniacida, etambutol y rifampicina. Sin embargo, recientemente se han informado cepas multidrogorresistentes.35-37
En este estudio se describe el primer caso informado en nuestro país de un paciente con sida que presentó infección simultánea pulmonar y ganglionar por M. szulgai. Queremos destacar lo atípico de las manifestaciones clínicas de este paciente, con coexistencia de infección diseminada pulmonar y ganglionar, a pesar de que su examen físico respiratorio fue negativo, al igual que su radiografía de tórax; sin embargo, todos los cultivos realizados fueron BAAR positivos. Este tipo de infección no es común, se encuentra sólo en pacientes que presenten alguna causa de deterioro en sus barreras inmunológicas, pacientes trasplantados, bajo terapia prolongada con corticoides y, especialmente, en los pacientes VIH/sida.37-38 En Cuba, la incidencia de compromiso ganglionar por el género Mycobacterium es relativamente baja, lo que atribuimos a la aplicación de terapia antirretroviral de gran actividad en el marco de un buen Programa Nacional de Atención al paciente VIH/sida.39-40
Se demostró una vez más que el cultivo con identificación de BAAR en muestras de biopsias a partir de fragmentos de tejido ganglionar obtenidas quirúrgicamente es más sensible que cuando se realiza la toma de muestras por aspiración con aguja fina.
Estos resultados demuestran una vez mas que se debe tener especial interés en todos los aislamientos micobacterianos, sobre todo provenientes de pacientes inmunodeficientes, en especial con enfermedad VIH/sida, pues el deterioro de su respuesta inmunológica puede permitir la aparición de formas diseminadas de infección por micobacterias atípicas, donde las consecuencias pueden ser fatales.