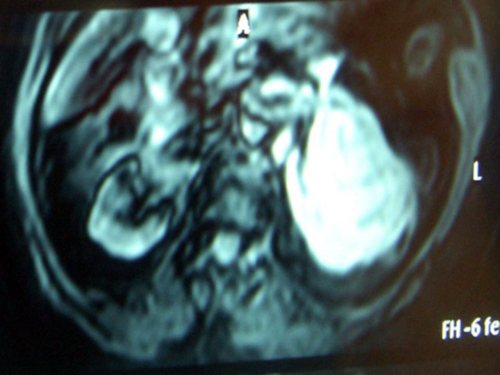
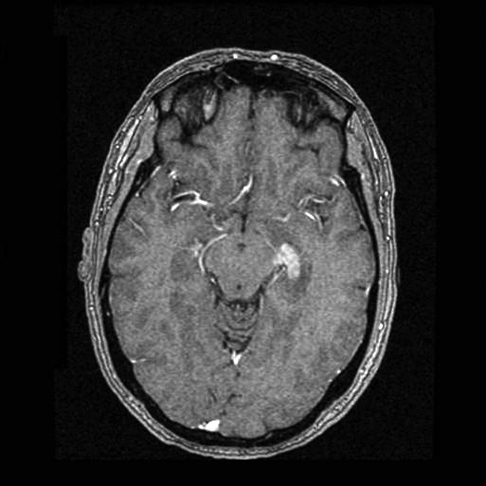
ACTUALIZACION DE LA CLINICA, EL DIAGNOSTICO Y EL TRATAMIENTO DEL LINFOMA RENAL PRIMARIO
Con el artículo se pretende realizar revisión actualizada sobre el origen, epidemiología, características clínicas, diagnóstico, pronóstico y especialmente del tratamiento del linfoma renal primario. Aunque no existe una terapia estándar dado el bajo número de casos, se revisan los resultados de tratamiento basados en quimioterapia con rituximab descritos en artículos recientes.
Institución del autor
Hospital Universitario Virgen de las Nieves, Granada, España
Coautores
Ignacio Puche Sanz* José Flores Martín* Francisco Javier Vicente Prados* Juan Manuel Cózar Olmo* Carolina Sánchez Ramos*
Hospital Universitario Virgen de las Nieves, Granada, España*
Primera edición en siicsalud
5 de diciembre, 2012