 Resumen
Introducción y objetivos: A pesar de que el estudio Antiplatelet Trialists' Collaboration demostró una reducción del 25% de los eventos mayores con el uso de aspirina en enfermos de alto riesgo, un porcentaje de pacientes presentan eventos isquémicos recurrentes. Esto ha llevado a la descripción de la "resistencia a la aspirina" con una tasa muy variable, de 0.4% a 83%. Este estudio evaluó la variabiliad en la función plaquetaria basal, la prevalencia de la resistencia a la aspirina, y la efectividad y reproducibilidad de los estudios de función plaquetaria. Materiales y métodos: Se llevó a cabo un estudio aleatorizado y cruzado de mediciones repetidas, con sujetos saludables de entre 18 y 60 años. Luego de firmar el consentimiento informado, los pacientes fueron distribuidos en forma aleatorizada a recibir aspirina en dosis de 75 mg o 300 mg; fueron evaluados al inicio y luego de cuatro períodos de tres semanas mediante diferentes técnicas: Optical Platelet Aggregation (OPA), PFA-100™, VerifyNow™, y los niveles séricos y urinarios de tromboxano B2 (TXB2). Se obtuvo la aprobación del comité de ética local. El análisis estadístico fue realizado con el programa SPSS17. Resultados: El índice global de resistencia a la aspirina fue variable, entre 2.4% y 63.5% en función de la técnica utilizada. Se demostró una variabilidad interindividual e intraindividual significativa al inicio y con la administración de placebo en las diferentes técnicas. La sensibilidad de los ensayos varió entre 24% (OPA ADP10) y 87.8% (tromboxano sérico), y la especificidad varió entre 81% (PFA-100™) y 97.4% (tromboxano). La selección de "valores de corte" alternativos provocó tasas de prevalencia diferentes de resistencia bioquímica a la aspirina, con un mecanismo de compensación entre la sensibilidad y la especificidad. Conclusiones: La respuesta a la aspirina mostró una marcada variabilidad interensayo, interindividual y temporal. Se requieren varias evaluaciones con diferentes técnicas para diagnosticar en forma confiable la resistencia a la aspirina. La selección de valores discriminativos alternativos debería considerarse al evaluar formalmente esta entidad.
Resumen
Introducción y objetivos: A pesar de que el estudio Antiplatelet Trialists' Collaboration demostró una reducción del 25% de los eventos mayores con el uso de aspirina en enfermos de alto riesgo, un porcentaje de pacientes presentan eventos isquémicos recurrentes. Esto ha llevado a la descripción de la "resistencia a la aspirina" con una tasa muy variable, de 0.4% a 83%. Este estudio evaluó la variabiliad en la función plaquetaria basal, la prevalencia de la resistencia a la aspirina, y la efectividad y reproducibilidad de los estudios de función plaquetaria. Materiales y métodos: Se llevó a cabo un estudio aleatorizado y cruzado de mediciones repetidas, con sujetos saludables de entre 18 y 60 años. Luego de firmar el consentimiento informado, los pacientes fueron distribuidos en forma aleatorizada a recibir aspirina en dosis de 75 mg o 300 mg; fueron evaluados al inicio y luego de cuatro períodos de tres semanas mediante diferentes técnicas: Optical Platelet Aggregation (OPA), PFA-100™, VerifyNow™, y los niveles séricos y urinarios de tromboxano B2 (TXB2). Se obtuvo la aprobación del comité de ética local. El análisis estadístico fue realizado con el programa SPSS17. Resultados: El índice global de resistencia a la aspirina fue variable, entre 2.4% y 63.5% en función de la técnica utilizada. Se demostró una variabilidad interindividual e intraindividual significativa al inicio y con la administración de placebo en las diferentes técnicas. La sensibilidad de los ensayos varió entre 24% (OPA ADP10) y 87.8% (tromboxano sérico), y la especificidad varió entre 81% (PFA-100™) y 97.4% (tromboxano). La selección de "valores de corte" alternativos provocó tasas de prevalencia diferentes de resistencia bioquímica a la aspirina, con un mecanismo de compensación entre la sensibilidad y la especificidad. Conclusiones: La respuesta a la aspirina mostró una marcada variabilidad interensayo, interindividual y temporal. Se requieren varias evaluaciones con diferentes técnicas para diagnosticar en forma confiable la resistencia a la aspirina. La selección de valores discriminativos alternativos debería considerarse al evaluar formalmente esta entidad.
 Palabras clave
tratamiento antiagregante plaquetario, resistencia a la aspirina, prueba de función plaquetaria, polimorfismos plaquetarios
Palabras clave
tratamiento antiagregante plaquetario, resistencia a la aspirina, prueba de función plaquetaria, polimorfismos plaquetarios
 Abstract
Abstract
Introduction: Despite the 25% reduction in major events with aspirin in high-risk patients reported by the Antiplatelet Trialists' Collaboration, a proportion of patients develop recurrent ischaemic events. This has led to the emergence of 'aspirin resistance' with rates between 0.4% and 83% reported. This study assessed variability in baseline platelet function, prevalence of aspirin resistance, and the performance and reproducibility of platelet function testing methods. Materials and Methods: A repeated-measures randomised crossover study was performed in healthy individuals aged 18-60 years. After informed consent, patients were randomised to aspirin dose (75 mg or 300 mg) and treatment sequence with testing at baseline and after each four 3-week treatment period via Optical Platelet Aggregation (OPA), PFA-100™, VerifyNow™, and serum and urinary thromboxane (TXB2) levels. Local ethical approval was granted. Statistical analysis was performed using SPSS17. Results: The overall rate of aspirin resistance varied from 2.4% to 63.5% depending on the assay used. Significant inter- and intra-individual variability existed at baseline and on placebo testing between assays. Assay sensitivities ranged from 24.0% (OPA ADP10) to 87.8% (serum TXB2), and specificities from 81.0% (PFA-100™) to 97.4% (serum TXB2). Selection of alternative "cut-off" values resulted in differing prevalence rates of biochemical aspirin resistance with a trade-off between sensitivity and specificity. Conclusions: Response to aspirin shows marked inter-assay, inter-individual and temporal variability. Testing on multiple occasions using several assays is necessary to reliably diagnose aspirin resistance. Selection of alternative assay "cut-off" values should be considered when formally assessing aspirin response.
 Key words
Key words
antiplatelet therapies, aspirin resistance, platelet function testing, platelet polymorphisms
Artículo completo
VARIABILIDAD DE LA RESPUESTA PLAQUETARIA A LA ASPIRINA
(especial para SIIC © Derechos reservados)
Introducción
En 1994, el estudio Antiplatelet Trialists’ Collaboration1 demostró una reducción del 25% en las tasas de mortalidad, infarto de miocardio y accidente cerebrovascular en más de 100 000 pacientes de alto riesgo. La aspirina es el inhibidor de la función plaquetaria más utilizado a nivel mundial, con abrumadora cantidad de pruebas en relación con el tratamiento de la aterosclerosis;2 no obstante, muchos pacientes presentan eventos isquémicos recurrentes aun bajo tratamiento con aspirina, lo que lleva al fenómeno descrito como resistencia a la aspirina.
En distintos trabajos se describió una prevalencia de la resistencia a la aspirina que varía entre 0.4% y 83%.3 Sin embargo, existen dificultades para la evaluación de la respuesta a la aspirina debido a la ausencia de consenso en su definición, una amplia variabilidad intraindividual e interindividual, así como una reproducibilidad regular de los ensayos de función plaquetaria.4 Se propusieron diferentes factores que contribuyen a la resistencia a la aspirina, entre ellos la diabetes,5 la baja adhesión al tratamiento,6 el consumo de cigarrillos, las interacciones medicamentosas, el uso previo de aspirina,7,8 la producción de isoprostano y el estrés oxidativo,9 la síntesis de ciclooxigenasa 2 (COX-2) extraplaquetaria,2 la disfunción endotelial y el incremento en la velocidad de recambio plaquetario. Por otro lado, también se propusieron polimorfismos genéticos en la COX-1 y la COX-2, en la glucoproteína IIb-IIIa y en los receptores purinérgicos P2Y1 y P2Y12.10
Siempre se ha supuesto que la prevalencia de resistencia a la aspirina en personas sanas sería menor, en comparación con la prevalencia en pacientes con enfermedad cardiovascular. Las tasas varían con las dosis de aspirina, con el tiempo de uso, y entre los ensayos utilizados. Mortensen y colaboradores11 hallaron una tasa del 4.8% mediante agregometría de transmisión óptica y del 9.6% con el analizador de función plaquetaria (platelet function analyser) PFA-100™ en 21 sujetos sanos luego del tratamiento con aspirina por cuatro días. Muir y colegas12 notificaron tasas variables de resistencia a la aspirina, detectada en 172 pacientes con enfermedad cardiovascular, con una mala correlación entre la agregometría plaquetaria óptica (optical platelet aggregation [OPA]), PFA-100 y los niveles séricos de tromboxano B2 (TXB2). Tanto la OPA como el método VerifyNow con ácido araquidónico presentaron una elevada sensibilidad y especificidad (entre 95.6% y 100%) en 45 sujetos saludables tratados con aspirina.13
Los objetivos de este estudio fueron evaluar la variabilidad en la función plaquetaria al inicio, y la reproducibilidad de la resistencia a la aspirina en sujetos saludables (mediante agregometría óptica, PFA-100, VerifyNow y los niveles urinarios y séricos de TXB2). Además, se evaluó la eficacia y la correlación de cada método de evaluación plaquetaria.
Materiales y métodos
Se trató de un ensayo clínico de mediciones repetidas, con entrecruzamiento, en un único centro en Belfast, Reino Unido. Los participantes fueron aleatorizados en dos grupos a recibir aspirina (75 mg o 300 mg) y a una secuencia de tratamiento ABBA, BAAB, BABA o ABAB (A = aspirina; B = placebo). La duración fue de 12 semanas y cada bloque de tratamiento fue de tres semanas. Todos los pacientes elegibles por su edad acudieron a una visita inicial para su incorporación y fueron seguidos hasta cinco veces. Se obtuvo la aprobación de la Office for Research Ethics Committee Northern Ireland (ORECNI) y de la Medicines and Healthcare Products Regulatory Agency (MHRA). El estudio fue registrado en la base de datos de ensayos clínicos controlados (ISRCTN71079188).
Los sujetos fueron incorporados en forma voluntaria mediante publicidad en la prensa local. Se consideraron elegibles las personas sanas, con edad entre 18 y 60 años. Los criterios de exclusión fueron el uso de antiagregantes plaquetarios o de antiinflamatorios no esteroides; los antecedentes de dispepsia o úlcera péptica que hubiera requerido tratamiento farmacológico; la presencia de enfermedad inflamatoria sistémica o asma; el uso de medicamentos que contengan aspirina; los antecedentes familiares de diátesis hemorrágica; el uso de anticoagulantes; un recuento plaquetario fuera de los valores normales; la presencia de anemia significativa; una cirugía mayor reciente; la presencia de neoplasias malignas, alergia a la aspirina o embarazo; las mujeres en edad gestacional; la intolerancia a la lactosa; los antecedentes de gota o de disfunción renal o hepática grave; el requerimiento de cirugía electiva a lo largo del estudio; el consumo excesivo de alcohol, y la imposibilidad de comprender y firmar el consentimiento informado.
Los pacientes fueron distribuidos en cada secuencia de tratamiento y dosis mediante un software que las programó en forma aleatoria. Los participantes y los miembros del estudio eran ciegos a las intervenciones. La aspirina fue provista por Victoria Pharmaceuticals (Belfast Health and Social Care Trust) y el placebo por Penn Pharmaceuticals o la University College London Production Unit. La medicación se entregó en contenedores sellados y recolectada por un investigador individual. La adhesión a las diferentes modalidades terapéuticas fue evaluada mediante entrevistas a los participantes y el recuento de pastillas. Se realizó una evaluación inicial de los niveles de hemoglobina y recuento de plaquetas mediante OPA, PFA-100™, VerifyNow™, así como de TXB2 sérico y urinario. Las muestras se tomaron entre dos y cuatro horas luego de la ingestión del fármaco, y al final de cada período de tres semanas. Luego, se procesaron y analizaron los resultados en el Departamento de Hemostasia del Belfast Health and Social Care Trust. Los niveles de TXB2 se evaluaron en el Centre for Public Health Research, de la Queen’s University Belfast.
La OPA fue realizada a 37°C mediante el uso del sistema Platelet Aggregation Profiler (PAP, [Bio/Data Corporation®, Horsham, PA, EE.UU.]). Las muestras fueron recolectadas en dos tubos S-Monovette® (Sarstedt Ltd, Reino Unido) y centrifugadas a 1000 rpm por diez minutos para obtener plasma rico en plaquetas. Se obtuvo un recuento de plaquetas ajustado y la agregación fue inducida con ácido araquidónico (AA, [Helena Biosciences, Reino Unido]) a 0.5 mg/ml, difosfato de adenosina (ADP) a 2, 5 y 10 µM (Sigma-Aldrich® Ltd., Dorset, Reino Unido), colágeno a 10 µg/ml (Helena Biosciences Europe, Gateshead, Reino Unido) o adrenalina a 25 µm/ml. La máxima agregación fue evaluada luego de diez minutos en forma de porcentaje. Se definió resistencia a la aspirina como la máxima agregación plaquetaria mayor del 20% con AA y mayor del 70% con ADP 10 µM en los sujetos en tratamiento con aspirina.
El sistema PFA-100™ (Dade-Behring, Alemania) fue utilizado con ADP y adrenalina, y con colágeno/adrenalina (C-EPI CT), y se definió resistencia a la aspirina al tiempo de cierre < 193 segundos.
La resistencia a la aspirina, analizada con el sistema VerifyNow™ (Accumetrics, San Diego, EE.UU.), se definió cuando las unidades de reacción a la aspirina (aspirin reaction unit, ARU) eran por lo menos 550.
Se utilizó el inmunoensayo enzimático competitivo ACE™ (Caiman Chemical, Michigan, EE.UU.) para medir los niveles de TXB2 sérico. Este ensayo mide la acción competitiva entre TXB2 y el marcador de TXB2-acetilcolinesterasa. El marcador es constante, por lo que la cantidad disponible se relaciona en forma inversamente proporcional con las concentraciones de TXB2. Se utilizó sangre entera coagulada antes de centrifugarse a 1000 rpm durante 15 minutos. El suero rico en TXB2 se retiró y se agregó solución de indometacina (10 µg/ml) antes de conservarlo a = -20°C. La curva estándar tuvo un valor de R2 de 0.9883. Se definió resistencia a la aspirina con niveles de TXB2 > 500 pg/ml.
Niveles de 11-deshidrotromboxano B2 urinario
Se utilizó un kit de ELISA para medir los niveles de 11-deshidrotromboxano B2 urinario (Corgenix UK Ltd, Peterborough, Reino Unido) y detectar cualitativamente el efecto de la aspirina. Las muestras de orina se conservaron a por lo menos -20°C. Se demostró una variación interensayo e intraensayo de 3.5% y 5.9%, respectivamente. Los resultados fueron calculados contra una curva de referencia y corregidos en función de la creatinina urinaria. Se definió la resistencia a la aspirina a partir de valores > 1500 pg/mg de creatinina en presencia de tratamiento con aspirina.
Análisis estadístico y cálculo del poder estadístico
Se utilizó el programa SPSS para Windows versión 17. Se realizó análisis univariado para detectar efectos del tratamiento, y para el análisis del TXB2 sérico se llevó a cabo una conversión logarítmica. Los resultados fueron informados con la prueba de Fisher, con grados de libertad (gl) y una significación del 5%. Se utilizó regresión logística para calcular la sensibilidad y especificidad de cada ensayo, y se construyeron curvas ROC de eficacia diagnóstica.
Resultados
Entre marzo de 2007 y febrero de 2009 se reclutaron 150 candidatos potenciales para el estudio. De ellos, 97 fueron excluidos, por lo que permanecieron en el estudio 53 personas. Luego de la evaluación inicial se excluyeron dos individuos más. La edad promedio fue de 31.6 años (desviación estándar [DE] 9.18, intervalo de confianza del 95% [IC 95%]: 2.65; 46 de los sujetos evaluados eran de sexo masculino.
Dos pacientes abandonaron el estudio por efectos adversos, dos por motivos médicos y tres por cuestiones personales. No se detectaron eventos adversos serios durante el período del estudio. En todas las visitas se evaluó la función plaquetaria mediante OPA con AA y con ADP 10, PFA-100 y el TXB2 sérico, pero no todos los casos contaron con las muestras para el TXB2 urinario. Los resultados del VerifyNow™ no estuvieron disponibles para todas las evaluaciones por dificultades en la distribución de los reactivos en Europa.
Variabilidad inicial en las pruebas de función plaquetaria
Se analizaron los resultados iniciales y su reproducibilidad fue evaluada con ensayos en función del placebo. La variabilidad se detectó con todos los ensayos; sin embargo, la mayor variabilidad se detectó con PFA-100, con TXB2 sérico, y con OPA-ADP (Figuras 1 a 5).
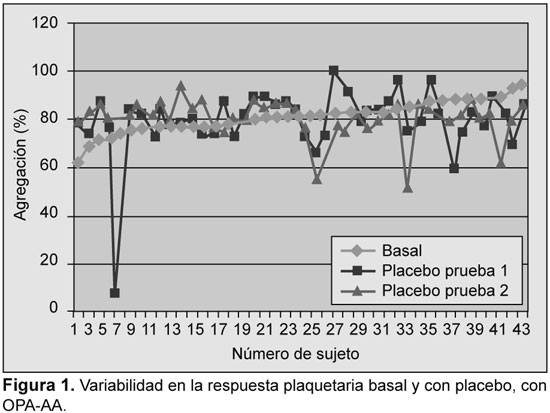
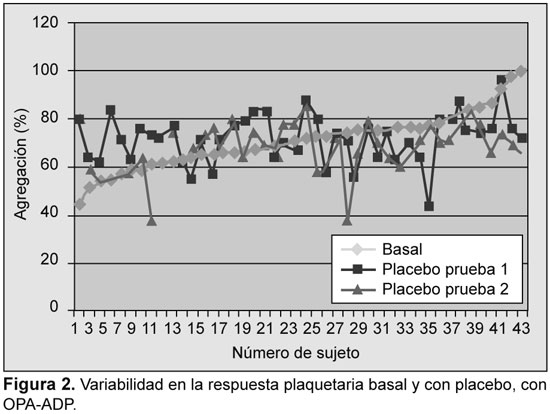
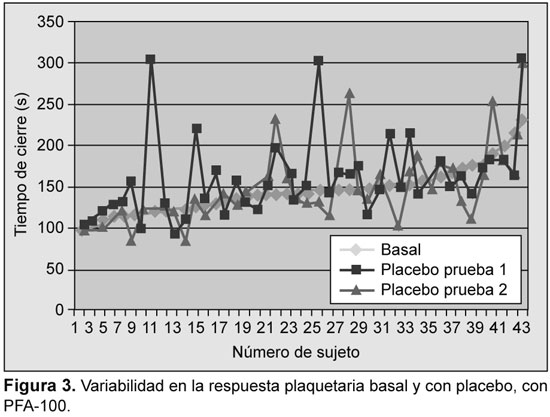
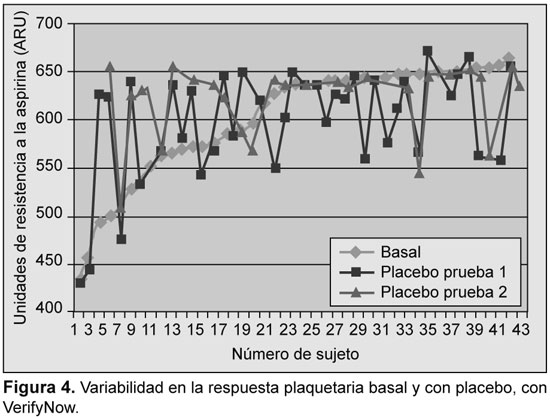
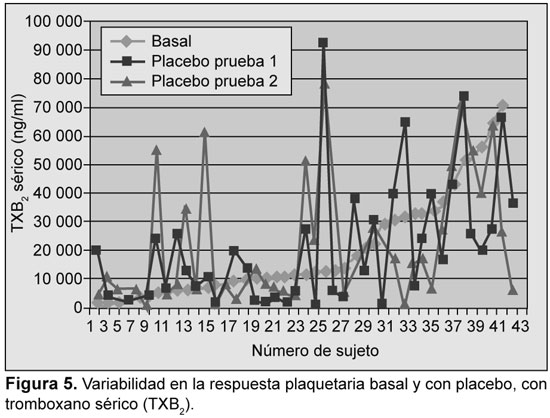
Prevalencia de resistencia a la aspirina
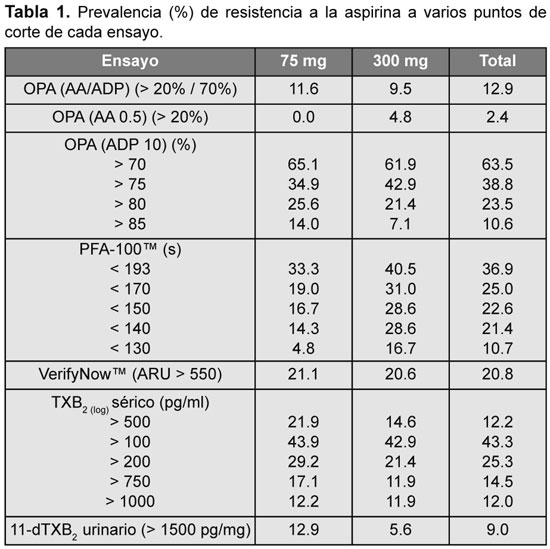
Se detectó una variabilidad significativa en la tasa de respuesta subóptima a la aspirina en función del análisis utilizado, desde 2.4% (con OPA-AA) hasta 63.5% (con OPA-ADP) (Tabla 1). Se encontró, además, variabilidad en la tasa de resistencia a la aspirina entre las dos dosis utilizadas (75 y 300 mg) con el TXB2 urinario (12.9% vs. 5.6%), con PFA-100™ (33.3% v 40.5%) y con TXB2 sérico (21.9% vs. 14.6%). Con la utilización sólo de OPA-AA la prevalencia de resistencia fue de sólo el 2.4%. En tres casos se describió resistencia con OPA-AA y OPA-ADP. De ellos, dos fueron resistentes con los demás métodos. Tres sujetos fueron resistentes con OPA en una visita, dos fueron resistentes con el VerifyNow y uno con PFA-100 en la misma visita.
Efecto de los tratamientos en función de los sujetos evaluados
El análisis univariado detectó modificaciones significativas en la respuesta al tratamiento con 75 mg de aspirina mediante OPA-AA (F = 7.0; gl 22, 36; p < 0.001), OPA-ADP 10 (F = 2.03; gl 22, 36; p = 0.029), TXB2 sérico logarítmico (F = 2.71; gl 20, 31; p = 0.006) y TXB2 urinario (F = 2.74; gl 19, 24; p = 0.018). El efecto del tratamiento fue significativo (5%) en todos los ensayos. No se observó modificación del efecto en función del tiempo. Sólo el PFA-100™ demostró efectos en relación con los sujetos (F = 3.76; gl 22, 18; p = 0.03). En el grupo que recibió 300 mg de aspirina no se observó una modificación en la resistencia a la aspirina en función del tratamiento interindividual, y nuevamente PFA-100™ demostró efectos en relación con los participantes estudiados (F = 2.42; gl 21, 20; p = 0.029).
Comparación entre los diferentes ensayos
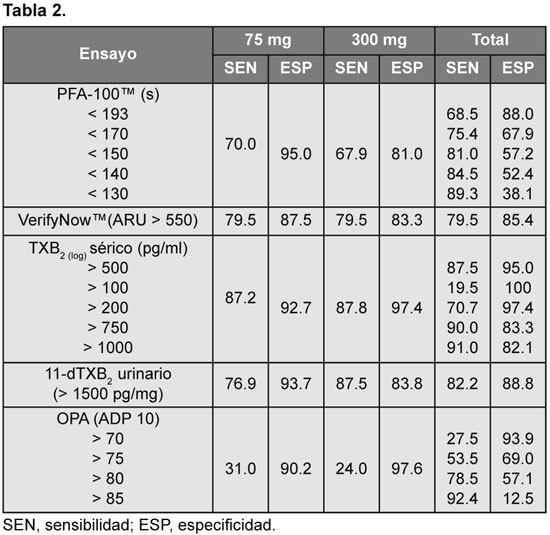
Los análisis de sensibilidad y especificidad se calcularon mediante la elaboración de curvas ROC (área bajo la curva [ABC] con el intervalo de confianza del 95%). Se utilizó como estudio patrón para las comparaciones al OPA-AA. Los resultados se citan en la Tabla 2.
Con la dosis de 75 mg, el TXB2 sérico tuvo una sensibilidad del 87.2% y una especificidad del 92.7%. El VerifyNow™ y el TXB2 urinario fueron menos sensibles al compararlos con OPA (79.5% y 76.9%, respectivamente), pero ambos presentaron una buena especificidad (87.5% y 93.7%, en igual orden) en sus respectivos valores de corte. El PFA-100™ demostró disparidad, con una sensibilidad baja del 70% y una elevada especificidad, del 95% (ABC ROC: 0.81; IC 95%: 0.72 a 0.90).
En el grupo que recibió 300 mg, los niveles de TXB2 sérico fueron sensibles (87.8%) y altamente específicos (97.4%) para detectar una correcta respuesta plaquetaria a la aspirina, con un valor de corte de 500 pg/ml. El TXB2 urinario también fue sensible (87.5%) y el VerifyNow tuvo mayor sensibilidad (79.5%) y especificidad (83.3%) al comparase con PFA-100 (sensibilidad 67% y especificidad 81%). La sensibilidad con OPA-ADP permaneció baja (24%).
Selección de valores discriminatorios alternativos
Tanto PFA-100 como OPA-ADP sobreestimaron la prevalencia esperable de resistencia bioquímica a la aspirina en este estudio. Los ensayos no fueron sensibles en los valores de corte predefinidos. Por ello, se seleccionaron valores discriminatorios alternativos y se recalculó la resistencia a la aspirina (Tabla 1). Para producir una tasa equivalente a OPA 10% de resistencia bioquímica a la aspirina, se deberían seleccionar los siguientes valores de corte: para PFA-100, CT < 130 segundos; para OPA-ADP, máxima agregación mayor del 85%, y para TXB2 sérico, niveles de 750 a 1000 pg/ml.
En estudios previos se definió la resistencia a la aspirina como niveles casi indetectables de TXB2 sérico. Si se utilizara dicha definición (por ejemplo, niveles menores de 100 pg/ml), la tasa global de resistencia a la aspirina en este estudio sería del 43.3%. Dicho valor excede la prevalencia esperada en personas sanas observada con otros trabajos. Para este estudio se tuvo en cuenta la sensibilidad y especificidad para alcanzar una prevalencia de resistencia a la aspirina equivalente a la detectada con OPA. Por ello, a pesar de que las definiciones alternativas proveen la tasa de resistencia esperada, la especificidad de la prueba es menor. El potencial beneficio de elegir un valor discriminatorio o de corte alternativo, por ello, es cuestionable.
Discusión y conclusiones
En este estudio acerca de la resistencia a la aspirina en individuos sanos, la prevalencia total utilizando OPA-AA y OPA-ADP 10 fue del 10.5%. Se halló una gran variabilidad, con valores entre 2.4% y 63.5%, dependiendo del tipo de ensayo utilizado, en forma similar a lo verificado por otros investigadores. Mortensen y colaboradores11 notaron una baja concordancia entre PFA-100 y OPA (kappa = 0.05) en un estudio con sujetos sanos. Muir y colaboradores12 demostraron, por su parte, una baja correlación entre OPA, TXB2 y PFA-100 en 172 pacientes con enfermedad cardiovascular demostrada.
Los estudios observacionales en la cabecera del paciente se llevaron a cabo con tasas variables de resistencia a la aspirina, del 20.8% (VerifyNow) y el 36.9% con PFA-100. En este estudio, tanto PFA-100 como OPA-ADP detectaron una elevada prevalencia de resistencia a la aspirina, en comparación con OPA-AA y los ensayos con TXB2. Con OPA-ADP, el 63.5% de los sujetos sanos presenta una respuesta a la aspirina subóptima. Además, ambos análisis variaron significativamente con el tiempo, entre los participantes y en cada medición en el mismo individuo. Esta mala concordancia había sido informada por Mortensen, quien describió una tasa de resistencia del 32.6% con PFA-100 y del 11.6% con OPA-AA.11 Se podría argumentar que la resistencia a la aspirina detectada con PFA-100 es un reflejo del fracaso en el análisis más que el fracaso en la aspirina. Por lo tanto, la selección del ensayo es fundamental para diagnosticar con precisión la resistencia a la aspirina. La menor tasa de resistencia a la aspirina fue la observada en los métodos dependientes de la COX. Con los resultados de este estudio, se podría concluir que la evaluación por una única vez no es suficiente para diagnosticar con certeza la resistencia a la aspirina. El método elegido como patrón en este estudio (OPA-AA y OPA-ADP) detectó tres casos de resistencia a la aspirina reproducible con una correlación variable entre los demás análisis.
Se detectó una variabilidad significativa en la respuesta al tratamiento entre los sujetos evaluados con las dosis de 75 mg, utilizando todos los ensayos. Esto permitiría evaluar variaciones genéticas en casos de resistencia a la aspirina. Sin embargo, ello no implica una contribución genotípica directa. Se detectaron respuestas variables entre los sujetos evaluados (por ejemplo, una pronunciada variabilidad interindividual e intraindividual) con PFA-100 en ambos grupos de tratamiento, en forma similar a lo informado por otros autores.12,16
El método más sensible para detectar la respuesta plaquetaria a la aspirina en este estudio fue OPA-AA, en forma similar a otros trabajos previos (Blais y colaboradores13 demostraron una sensibilidad del 95.9% y una especificidad del 100%). El desempeño en el estudio actual del ensayo VerifyNow demostró una sensibilidad del 79.5% y una especificidad del 87.5%, con un valor discriminatorio de 550 ARU, y estos resultados son similares a los informados previamente.17 Los análisis menos sensibles a los valores de corte respectivos fueron PFA-100 (70%) y OPA-ADP (31%). La elección de valores alternativos para los ensayos menos sensibles y para el TXB2 sérico llevó a una prevalencia de resistencia bioquímica a la aspirina similar a la detectada con OPA-AA. Sin embargo, ello implicó una menor sensibilidad y especificidad de los métodos. Más aún, parece evidente que la resistencia bioquímica a la aspirina no se traduce en una resistencia clínica, ya que los eventos adversos no se observan en la práctica cotidiana a una tasa del 10%.
Se describen varias limitaciones en este trabajo. El estudio tuvo una fortaleza insuficiente para determinar una posible contribución genética debido a la pequeña cantidad de participantes. Los resultados de VerifyNow y del 11-deshidrotromboxano B2 urinario no se obtuvieron en muchos casos. La mayoría de los individuos eran varones. Se demostró concordancia subóptima en dos pacientes resistentes con un mismo ensayo. Una potencial solución para superar este problema sería la administración de aspirina observada directamente, con la evaluación subsiguiente de la función plaquetaria.18
En conclusión, en este estudio de entrecruzamiento acerca de la resistencia a la aspirina en sujetos sanos, se demostró una gran variabilidad en función del ensayo utilizado, el tiempo y los individuos. La selección del ensayo más apropiado es fundamental para definir de manera confiable la resistencia a la aspirina. Se podría afirmar que la utilidad de OPA-ADP es cuestionable, ya que este ensayo sobreestima significativamente la prevalencia de la resistencia. La selección de un valor discriminatorio, o de corte, alternativo para definir la resistencia a la aspirina también debería considerarse. Las definiciones convencionales de resistencia bioquímica a la aspirina estratifican la respuesta plaquetaria en forma dicotómica. Sin embargo, como la respuesta es un espectro continuo, se podría sugerir que el término resistencia a la aspirina debería ser reemplazado por respuesta a la aspirina, para poder categorizar valores de agregación inducida por AA del 19% y 21% como sensible y resistente, respectivamente. Además, puede tener lugar una variación inicial de la respuesta plaquetaria, incluso en individuos sanos. Quizá se debería utilizar una definición más apropiada de resistencia a la aspirina en forma individual, como el porcentaje de reducción sobre un valor inicial (por ejemplo, 25% de inhibición con respecto al inicio) más que una definición convencional ajustada a toda la población. Una única evaluación con un único método es insuficiente para diagnosticar la resistencia a la aspirina en forma certera. Los estudios que reflejan los mecanismos dependientes de la COX fueron los marcadores más robustos de respuesta a la aspirina. A futuro, parece posible una terapia antiagregante plaquetaria ajustada a cada individuo, pero en la actualidad no se han podido demostrar dichas estrategias. El diagnóstico de resistencia bioquímica a la aspirina no necesariamente es igual a la resistencia a la terapia antiagregante plaquetaria en el contexto de la práctica clínica.
|
 Bibliografía del artículo
Bibliografía del artículo
1. Antiplatelet Trialists' Collaboration. Collaborative overview of randomized trials of antiplatelet therapy. I: prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. BMJ 308:81-106, 1994.
2. Mason PJ, Jacobs AK, Freedman JE. Aspirin resistance and atherothrombotic disease. J Am Coll Cardiol 46:986-93, 2005.
3. Gum PA, Kottke-Marchant K, Poggio ED, Gurm H, Welsh PA, Brooks L, et al. Profile and prevalence of aspirin resistance in patients with cardiovascular disease. Am J Cardiol 88:230-35, 2001.
4. Gurbel PA, Tantry US. Clopidogrel resistance? Thromb Res 120:311-21, 2007.
5. Watala C, Pluta J, Golanski J, Rozalski M, Czyz M, Trojanowski Z et al. Increased protein glycation in diabetes mellitus is associated with decreased aspirin-mediated protein acetylation and reduced sensitivity of blood platelets to aspirin. J Mol Med 83:148-58, 2005.
6. Cotter G, Shemesh E, Zehavi M, Dinur I, Rudnick A, Milo O et al. Lack of aspirin effect: aspirin resistance or resistance to taking aspirin? Am Heart J 147:293-300, 2004.
7. Alexander JH, Harrington RA, Tuttle RH, Berdan LG, Lincoff AM, Deckers JW et al. Prior aspirin use predicts worse outcomes in patients with non-ST-elevation acute coronary syndromes. PURSUIT Investigators. Platelet IIb/IIIa in Unstable Angina: Receptor Suppression Using Integrilin Therapy. Am J Cardiol 83:1147-51, 1999.
8. Antman EM, Cohen M, Bernink PJLM, McCabe CH, Horacek T, Papuchis G et al. The TIMI risk score for unstable angina/non-ST elevation MI: a method for prognostication and therapeutic decision making. JAMA 284:835-42, 2000.
9. Cipollone F, Ciabattoni G, Patrignani P, Pasquale M, Di Gregorio D, Bucciarelli T et al. Oxidant stress and aspirin-insensitive thromboxane biosynthesis in severe unstable angina. Circulation 102:1007-13, 2000.
10. Faraday N, Yanek LR, Mathias R, Herrera-Galeano JE, Vaidya D, Moy TF et al. Heritability of platelet responsiveness to aspirin in activation pathways directly and indirectly related to cyclooxygenase-1. Circulation 115:2490-96, 2007.
11. Mortensen J, Poulsen TS, Grove EL, Refsgaard J, Nielsen HL, Pedersen SB et al. Monitoring aspirin therapy with the platelet function analyser-100. Scand J Clin Lab Invest 68:786-92, 2008.
12. Muir AR, Patterson C, McMullin MF, McKeown PP. Assessment of aspirin resistance varies on a temporal basis in patients with ischaemic heart disease. Heart 95:1225-9, 2009.
13. Blais N, Pharand C, Lordkipanidze M, Sia YK, Merhi Y, Diodati JG. Response to aspirin in healthy individuals. Cross-comparison of light transmission aggregometry, VerifyNow system, platelet count drop, thromboelastography (TEG), and urinary 11-dehydrothromboxane B2. Thromb Haemost 102:404-11, 2009.
14. Akay OM, Canturk Z, Akin E, Bal C, Gulbas Z. Aspirin resistance frequency: a prospective study in 280 healthy Turkish volunteers. Clin Appl Thromb Hemost 15:98-102, 2009.
15. Madsen EH, Schmidt EB, Maurer-Spurej E, Kristensen SR. Effects of aspirin and clopidogrel in healthy men measured by platelet aggregation and PFA-100. Platelets 19:335-41, 2008.
16. Nielsen HL, Kristensen SD, Thygesen SS, Mortensen J, Pedersen SB, Grove EL et al. Aspirin response evaluated by the VerifyNow aspirin system and light transmission aggregometry. Thromb Res 123:267-73, 2008.
17. Tantry US, Bliden KP, Gurbel PA. Overestimation of platelet aspirin resistance detection by thromboelastograph platelet mapping and validation by conventional aggregometry using arachidonic acid stimulation. J Am Coll Cardiol 49:1705-9, 2005.
|
|
