 Resumen
Objetivos: brindar una revisión del retratamiento radiante en el enfoque de las pacientes con recurrencia ipsilateral del cáncer de mama (RICM). Materiales y métodos: se efectuó una revisión de la bibliografía recinete y se la correlacionó con nuestra amplia experiencia de retratamiento en pacientes tratadas en forma original con tumorectomía y radioterapia postoperatoria en el marco de una RICM. Se informan los resultados actualizados de nuestras pacientes tratadas con implantes intersticial transitorios de baja dosis (LDR), braquiterapia con balón a altas dosis (HDR) o radioterapia conformacional tridimensional (3D-CRT) y su comparación con los resultados descritos por otros autores. Resultados: un total de 42 pacientes fueron tratadas según nuestro protocolo. Después de una media de seguimiento de 67.5 meses (intervalo de 5 a 115 meses), 21 de las 22 mujeres tratadas con LDR lograron control local después del último control o al momento del fallecimiento. La única paciente que presentó una segunda recurrencia local se trató de forma exitosa con mastectomía. Una de las 15 mujeres que recibieron HDR evolucionó con una recurrencia inflamatoria que se trató de forma exitosa con mastectomía de rescate. En las 5 pacientes tratadas con 3D-CRT se logró preservación mamaria. Dos de las pacientes que recibieron LDR presentaron disrupción cutánea localizada. Cinco de las 42 participantes murieron; 3 casos se atribuyeron a cáncer mamario metastático. Una de las pacientes falleció como consecuencia de enfermedad pulmonar obstructiva crónica. Otra enferma murió por complicaciones cardíacas de la radioterapia previa. En una de las mujeres se verificó aparición de cáncer de mama contralateal. Los resultados estéticos a largo plazo, definidos por la escala cosmética de Harvard y la modificación de Allegheny General (AGH) se consideraron aceptables. La escala AGH fue más precisa para notificar los cambios estéticos. Conclusiones: estos datos a largo plazo permite sugerir que la repetición de la tumorectomía y de la radioterapia posquirúrgica son factibles y podrían representar una alternativa a la mastectomía de rescate en las pacientes que evolucionan con RICM después de una cirugía de preservación mamaria. Se requiere un mejor sistema de cuantificación estética (escala AGH) para una identificación más adecuada del resultado cosmético posterior al retratamiento.
Resumen
Objetivos: brindar una revisión del retratamiento radiante en el enfoque de las pacientes con recurrencia ipsilateral del cáncer de mama (RICM). Materiales y métodos: se efectuó una revisión de la bibliografía recinete y se la correlacionó con nuestra amplia experiencia de retratamiento en pacientes tratadas en forma original con tumorectomía y radioterapia postoperatoria en el marco de una RICM. Se informan los resultados actualizados de nuestras pacientes tratadas con implantes intersticial transitorios de baja dosis (LDR), braquiterapia con balón a altas dosis (HDR) o radioterapia conformacional tridimensional (3D-CRT) y su comparación con los resultados descritos por otros autores. Resultados: un total de 42 pacientes fueron tratadas según nuestro protocolo. Después de una media de seguimiento de 67.5 meses (intervalo de 5 a 115 meses), 21 de las 22 mujeres tratadas con LDR lograron control local después del último control o al momento del fallecimiento. La única paciente que presentó una segunda recurrencia local se trató de forma exitosa con mastectomía. Una de las 15 mujeres que recibieron HDR evolucionó con una recurrencia inflamatoria que se trató de forma exitosa con mastectomía de rescate. En las 5 pacientes tratadas con 3D-CRT se logró preservación mamaria. Dos de las pacientes que recibieron LDR presentaron disrupción cutánea localizada. Cinco de las 42 participantes murieron; 3 casos se atribuyeron a cáncer mamario metastático. Una de las pacientes falleció como consecuencia de enfermedad pulmonar obstructiva crónica. Otra enferma murió por complicaciones cardíacas de la radioterapia previa. En una de las mujeres se verificó aparición de cáncer de mama contralateal. Los resultados estéticos a largo plazo, definidos por la escala cosmética de Harvard y la modificación de Allegheny General (AGH) se consideraron aceptables. La escala AGH fue más precisa para notificar los cambios estéticos. Conclusiones: estos datos a largo plazo permite sugerir que la repetición de la tumorectomía y de la radioterapia posquirúrgica son factibles y podrían representar una alternativa a la mastectomía de rescate en las pacientes que evolucionan con RICM después de una cirugía de preservación mamaria. Se requiere un mejor sistema de cuantificación estética (escala AGH) para una identificación más adecuada del resultado cosmético posterior al retratamiento.
 Palabras clave
cáncer de mama, recurrencia ipsilateral del cáncer de mama, radioterapia, preservación mamaria
Palabras clave
cáncer de mama, recurrencia ipsilateral del cáncer de mama, radioterapia, preservación mamaria
 Abstract
Abstract
Purpose: To provide an overview of the state of retreatment irradiation in the management of patients who develop ipsilateral breast tumor recurrence (IBTR). Materials and methods: We reviewed the modern literature and correlated it with our extensive experience in retreatment of the breast in patients originally treated with lumpectomy and post-operative irradiation following IBTR. We report the updated results of our patients treated by low dose rate temporary interstitial implant (LDR), high dose rate (HDR) balloon brachytherapy, and three dimensional conformal radiotherapy (3-D CRT), and compare these to results reported by other authors. Results: A total of 42 patients have been treated on our protocol. With a mean follow up of 67.5 months (range 5-115 months), twenty-one of 22 LDR patients achieved local control at the time of last follow-up, or at the time of their death. The single patient who developed a second local recurrence was treated successfully with mastectomy. One of 15 HDR patients developed an inflammatory recurrence and was successfully treated by salvage mastectomy. All five 3-D CRT patients have retained their breasts. Two LDR patients developed localized skin breakdown. Five of 42 patients have expired with 3/5 succumbing to metastatic breast cancer. One patient died from chronic obstructive pulmonary disease, and one died from cardiac complications secondary to previous mantle radiotherapy. One patient developed a contralateral breast cancer. Long-term cosmetic results as defined by the Harvard cosmesis scale and the Allegheny General (AGH) modification were acceptable, and the AGH modification more accurately reported cosmetic changes. Conclusions: These long-term data suggest that repeat lumpectomy followed by repeat post-operative radiotherapy is feasible and may be an acceptable alternative to salvage mastectomy in patients who develop IBTR following conservation breast therapy. An improved cosmetic reporting system (the AGH modification) is required to more accurately identify post-retreatment cosmesis.
 Key words
Key words
breast cancer, ipsilateral breast tumor recurrence, radiotherapy, breast conservation
Artículo completo
LA RADIOTERAPIA EN LA RECURRENCIA IPSILATERAL DEL CANCER DE MAMA TRAS LA PRESERVACION DE LA GLANDULA
(especial para SIIC © Derechos reservados)
Introducción
En la actualidad, se han superado los 20 años de seguimiento de los 2 estudios independientes de fase III en los que se demostró la equivalencia entre la tumorectomía sucedida de radioterapia postoperatoria como terapia de elección para la conservación mamaria, en reemplazo de la mastectomía como tratamiento local principal1,2, con tasas de fracaso terapéutico local de hasta el 14%. En todo el mundo, la incidencia de cáncer de mama (CM) es superior a un millón de mujeres al año.3 Una tasa de recurrencia de 2% a 14% equivaldría a 20 000 a 140 000 casos de recurrencia ipsilateral de CM (RICM); la mayor parte de estas pacientes podría beneficiarse con un nuevo intento de preservación mamaria. Actualmente se acepta que la terapia convencional de la RICM es la mastectomía de rescate, para la cual se ha demostrado un excelente índice de control local que supera el 90%,4,5 pero los resultados cosméticos y funcionales no son adecuados. Se han descrito efectos psicológicos y a largo plazo de la mastectomía, así como alteraciones emocionales y físicas posteriores. Ganz y colaboradores han demostrado una clara relación causal entre la mastectomía y las dificultades prácticas, así como con una imagen corporal subjetiva negativa.6
Rowland y colaboradores observaron que las mujeres sometidas a mastectomía con reconstrucción presentaban una mayor incidencia de repercusión negativa sobre su vida sexual (45.4%), contra el 29.8% de las pacientes tratadas mediante tumorectomía.7 Maunsell y colaboradores informaron que las mujeres jóvenes (menores de 40 años) eran afectadas de un modo significativamente menos negativo por la terapia de conservación mamaria, en comparación con la mastectomía.8
Los datos acerca de la radioterapia mamaria acelerada parcial (RMAP) han alcanzado una media mínima de seguimiento de 5 años en 5 estudios unicéntricos o multicéntricos.9-13 En todos esos ensayos se ha demostrado que la eficacia y la seguridad de la RMAP son equivalentes a las de la mastectomía. En 2 informes adicionales con más de 10 años de seguimiento se comprobaron tasas de control local de 91% a 95% en relación con la RMAP.14-15 Estos datos conforman la información científica que fundamenta nuestra tarea en términos del retratamiento. En este artículo ofrecemos nuestros resultados y una revisión de la bibliografía.
Materiales y métodos
Entre enero de 1998 y mayo de 2011, en 42 pacientes con RICM en estadio Tis o T1 se indicó radioterapia bajo internación a continuación de una nueva exéresis quirúrgica como alternativa a la mastectomía de rescate, en el marco de un protocolo aprobado por el Comité Institucional de Revisión. Tres de estas pacientes habían recibido en forma previa radioterapia con inclusión de los campos mamarios en asociación con irradiación axilar por neoplasias no mamarias (2 casos de linfoma de Hodgkin y un 1 caso de linfoma no Hodgkin). Estas mujeres se incluyeron en este grupo de retratamiento, debido a que las neoplasias surgieron en la región axilar y en el contexto de un área anatómica que recibió dosis completas de radiación local (no menos de 4 500 cGy) y, de otro modo, hubieran sido candidatas a la mastectomía. En todas las participantes con diagnóstico inicial de CM había fracasado el tratamiento con tumorectomía y radioterapia externa postoperatoria del volumen mamario (4 500 a 5 040 cGy); en 21 pacientes se había indicado una dosis de refuerzo sobre el lecho tumoral (1 000 a 2 000 cGy).
La mediana de edad al momento del diagnóstico original para todo el grupo era de 55.5 años (intervalo de 25 a 89 años). El promedio del tiempo transcurrido hasta la recaída era de 10.6 años (intervalo de 0.4 a 46.0 años). Cinco mujeres recibieron inicialmente quimioterapia sistémica (incluidas las 2 pacientes con linfoma de Hodgkin) y un total de 27 participantes habían sido tratadas al menos con un modulador hormonal (tamoxifeno, anastrazol o ambos) en alguna etapa. Una paciente fue tratada con traztuzumab además de la quimioterapia sistémica. En 24 mujeres la recurrencia surgió a menos de 1 cm del tumor original, en 5 casos fue en “algún sitio”, en otras 13 se describió en una localización no determinada en comparación con el tumor inicial y en las 3 pacientes restantes la neoplasia surgió en el tejido mamario previamente irradiado como tratamiento de un linfoma. Aunque estas mujeres no evolucionaron con una típica RICM, se incluyeron en esta cohorte de estudio dado que se diagnosticó un CM sobre un área mamaria irradiada en forma previa. Como criterio de inclusión, se consideró la ausencia de metástasis a distancia o de adenopatías regionales documentadas al examen físico, la radiografía de tórax, la tomografía computarizada (TAC), la gammagrafía ósea y un laboratorio sérico exhaustivo. En la única paciente con enfermedad metastásica antes del implante se había indicado quimioterapia en altas dosis y trasplante de médula ósea, las cuales constituían el tratamiento de elección al momento del diagnóstico. En esta enferma se había comprobado clínicamente la ausencia de enfermedad en los 2 años previos a la aparición de la RICM y no se verificó la presencia de afectación a distancia.
A partir de 2004, se realizaron en forma preoperatoria imágenes por resonancia magnética en todas las pacientes antes de la repetición de la tumorectomía; no se incluyeron en el estudio participantes con sospecha de enfermedad diseminada o lesiones mamarias contralaterales confirmadas por mamografía, ecografía o resonancia magnética.
A todas las pacientes se informó con claridad que la mastectomía de rescate constituía el tratamiento convencional. En 11 mujeres, el implante se realizó al momento de la nueva tumorectomía, en forma posterior a la exéresis de la recurrencia tumoral. En estos casos, se requirieron márgenes negativos en la pieza quirúrgica demostrados por congelación. Se demostró la negatividad de todos los márgenes quirúrgicos en la evaluación patológica final antes de la colocación de los catéteres de braquiterapia. Se definió como margen final negativo de resección a la ausencia de tumor en los límites de la pieza quirúrgica, de acuerdo con las recomendaciones del National Surgical Adjuvant Breast and Bowel Project (NSABP). Desde el comienzo del estudio, se decidió el tratamiento con radioterapia a dosis plena (dosis de 4 500 cGy para los implantes intersticiales transitorios de baja dosis [LDR], 3 400 cGy para la braquiterapia de alta dosis con balón [HDR] y 3 850 cGy para la radioterapia conformacional tridimensional [3D-CRT]), en oposición a la terapia de dosis escalonada. De todos modos, una paciente tratada con HDR recibió sólo 3 000 cGy en 10 dosis de 2 aplicaciones diarias dada la fragilidad de la piel mamaria y su avanzada edad (89 años).
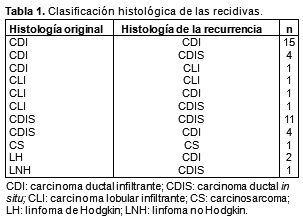
En la tabla 1 se informa la histología original y la de las recurrencias. Se utilizaron grapas quirúrgicas para identificar el lecho tumoral por métodos radiográficos; sin embargo, este abordaje se consideró innecesario para las imágenes por TAC de alta resolución, en la cual se reveló el lecho tumoral en forma muy precisa en el período posquirúrgico inmediato. Por lo tanto, este requisito fue descartado.
Técnica quirúrgica y planificación de los implantes LDR
Se efectuaron implantes en el lecho tumoral en las 22 pacientes que recibieron terapia intersticial de tipo LDR mediante catéteres de poscarga en el volumen clínico, definido como el lecho tumoral o el seroma de la cavidad con un margen no menor de 1 cm. Después de la reevaluación de la técnica en el contexto de los efectos adversos dermatológicos agudos de grado III de la Common Terminology Criteria for Adverse Events (CTCAE, versión 3.0)16, la estrategia LDR se modificó por medio de la limitación del implante de las semillas de braquiterapia en los catéteres con una profundidad mínima de 1 cm por debajo de la piel para reducir la dosis cutánea total. Con la actualización de la versión 4.0 de la CTCAE, se utilizó un espacio de 1.5 cm entre los catéteres coplanares adyacentes, con planos adyacentes de separación de 1 cm. En 20 de las 22 pacientes que recibieron LDR, el volumen de implante se confirmó mediante TAC con reconstrucción tridimensional para analizar los parámetros volumétricos. En los otros 2 casos, el cálculo se realizó mediante radiografía ortogonal, dado que la estimación de la dosimetría por TAC no estaba aún disponible. Se implantó iridio 192 (media de actividad de 0.62 mg-Ra-eq) en un procedimiento de poscarga con las pacientes internadas, para lograr un dosis total de 4 500 a 5 000 cGy (intervalo de 4 500 a 5 530 cGy). El promedio del V100 (volumen que recibe el 100% de la dosis) era de 105.44 cm3 (intervalo de 36 a 260 cm3). La media del V150 se estimó en 29.78 cm3 (intervalo de 0 a 105 cm3) y la del V200 era de 7 cm3. El promedio de la duración de la internación fue de 4.5 días.
Técnica y planificación de los implantes HDR
Las pacientes que recibieron HDR fueron tratadas de acuerdo con los parámetros para terapia de novo propuestos por el protocolo B-39 del BSABP.17 Todas las mujeres recibieron una dosis de 3 400 cGy en 2 fracciones diarias de 340 cGy, administradas con intervalos mínimos de 6 h. La dosis se prescribió a una distancia de 1 cm del balón de superficie. El volumen de prescripción se definió de acuerdo con el protocolo B-39, para excluir la pared torácica (incluidos los músculos pectorales) y a una distancia de 5 mm desde la superficie cutánea si estas estructuras se localizaban en la proximidad del balón para proteger las costillas y la piel, en ese orden. Esta definición corresponde al protocolo Planning Tumor Volumen for Evaluation (PTV_EVAL). En todas las pacientes se efectuó una planificación tridimensional del volumen de tratamiento.
Técnica y planificación de la 3D-CRT
La radioterapia externa se administró también de acuerdo con los parámetros para el tratamiento de novo de acuerdo con los estándares B-39.17 Todas las pacientes recibieron una dosis planificada de 3 850 cGy en 2 fracciones diarias de 385 cGy, administradas con intervalos mínimos de 6 h. En estas mujeres, el volumen tumoral clínico se definió en principio como el lecho de exéresis del tumor, que podía consistir en un seroma o en aire expandido en forma uniforme por 15 mm. Finalmente se agregó un volumen adicional de 10 mm al volumen clínico para dar lugar al volumen planificado total. De un modo similar al empleado en las pacientes tratadas con braquiterapia con balón, el volumen de prescripción se modificó en función del protocolo B-39 para excluir la pared torácica total y a una distancia de 5 mm de la superficie cutánea si estas estructuras se encontraban en la proximidad de las costillas o de la piel mamaria, respectivamente. Esta estrategia de evaluación para planificación del volumen correspondía al protocolo PTV_EVAL. Al igual que con otros modelos, en la planificación se utilizaron técnicas de volumetría tridimensional en todas las pacientes.
Los resultados estéticos fueron evaluados por los médicos tratantes mediante los criterios Harvard/NSABP18 (tabla 2) y Allegheny General Modification19 ([AGM]; Tabla 3). Hemos elaborado la AGM a partir de la escala original Harvard/NSABP para clasificar de modo más apropiado el efecto cosmético de las mamas sometidas a retratamiento. En esta modificación, se cuantifican los resultados estéticos después de la nueva cirugía por medio de la estimación de un puntaje basal, con el fin de evaluar de mejor manera la repercusión de la reiteración de la radioterapia.


Resultados
Cuarenta de 42 pacientes (95%) estaban libres de enfermedad local, con una mediana de seguimiento de 67.5 meses (intervalo de 5 a 115 meses). En 2 mujeres se observó disrupción de la herida después de la nueva tumorectomía y del implante intersticial, con subsecuente cicatrización por primera intención. La técnica se modificó de acuerdo con la descripción anterior para reducir la dosis cutánea. Tras esta modificación, ninguna paciente evolucionó con complicaciones de grado 3. No se identificaron correlaciones entre la toxicidad aguda y el pronóstico estético final.
Una de las pacientes presentó una segunda RICM a los 23 meses del implante. Esta mujer fue tratada inicialmente en 1990 con tumorectomía y radioterapia postoperatoria de todo el volumen mamario (5 040 cGy), con un refuerzo adicional del lecho tumoral de 1 440 cGy. Su segunda RICM ocurrió en el centro geográfico del volumen de alta dosis del cuadrante superoexterno de la mama, con administración de 5 500 cGy (V110) durante el implante intersticial. Los márgenes de la resección eran negativos y no se observó extensión intraductal. La histología correspondía a carcinoma ductal tanto en la etapa inicial como en la recurrencia. No obstante, sólo se demostró comedonecrosis en la recurrencia. La paciente se trató en forma exitosa con mastectomía simple de recate y continúa libre de enfermedad después de 8 años de la cirugía.
La otra mujer que evolucionó con recurrencia presentó originalmente un carcinoma ductal infiltrante (CDI) de grado nuclear intermedio (lesión inicial de 1 cm), mientras que la recurrencia consistía en un CDI de 2 cm que surgió 9 años después. La nueva recurrencia era un carcinoma inflamatorio aparecido en el campo de radiación. En esta paciente se observaron metástasis cerebrales y óseas.
En una de las participantes se comprobó necrosis grasa sucedida de una mastitis fulminante que requirió una mastectomía simple; no se identificó tejido tumoral en la pieza quirúrgica.
Dos de las pacientes murieron por metástasis diseminadas a los 17 y 24 meses de la colocación de los implantes, respectivamente. Una de ellas presentó metástasis antes de la braquiterapia, pero había sido evaluada como paciente libre de enfermedad por 2 años tras la indicación de quimioterapia en altas dosis y trasplante autólogo de médula ósea antes de la colocación del implante; estos recursos constituían el tratamiento de elección para ese entonces. La segunda mujer evolucionó con metástasis cerebrales (sin confirmación histológica, pero con sospecha de CM) a los 24 meses de los implantes de braquiterapia.
Una tercera paciente falleció por insuficiencia respiratoria 12 meses después del implante, como consecuencia de complicaciones relacionadas con una enfermedad pulmonar obstructiva crónica de larga evolución. En la TAC realizada inmediatamente antes de la muerte no se demostraron anomalías pulmonares que permitieran sospechar enfermedad actínica. Todas las enfermas que murieron no presentaban fracaso de la terapia local al momento del deceso. Cuando las mujeres que fallecieron por enfermedad precoz se excluyeron del análisis, la media de seguimiento se incrementó de 67.5 meses a 74 meses. Una de las participantes presentó CM contralateral que fue tratado de forma exitosa con cirugía mamaria local de preservación.
Pacientes tratadas con LDR
Al finalizar el seguimiento, se calculó el puntaje estético de las pacientes tratadas con LDR (escala Harvard/SNABP; tabla 2), considerado de grado 1 en 13 casos, de grado 2 en 6 mujeres y de grado 3 en otras 3 enfermas. Ninguna de las pacientes recibió un puntaje de grado 4. Las 2 participantes con disrupción cutánea significativamente más grave se categorizaron con un resultado estético de grado 2 cuando se completó la cicatrización. Se informaron telangiectasias en 5 pacientes. En 5 mujeres se verificaron peores resultados cosméticos después de la radiación, que se demostraron de mejor forma mediante la escala AGM (tabla 3). Dos mujeres presentaron un resultado estético de grado A1-A2, mientras que otras 3 se clasificaron como de grado A2-A3. Todos los resultados estéticos se estabilizaron a los 2 a 2.5 años posteriores al implante. En nuestra evaluación de las pacientes con un puntaje cosmético final de 3 puntos, verificamos que ambas mujeres presentaban escaso parénquima mamario para colocar los implantes antes del procedimiento. Se llevó a cabo una encuesta verbal de las 22 participantes a los 6 meses y al año después del implante; todas se encontraban satisfechas con la realización del procedimiento de preservación mamaria, en comparación con la mastectomía, incluida la paciente que evolucionó con una nueva RICM.
Pacientes tratadas con HDR
Ninguna de las participantes tratadas con HDR evolucionó con un eritema superior al grado 1 a nivel local. Siete de las 13 enfermas que recibieron braquiterapia con balón presentaron un puntaje estético final (escala Harvard/NSABP) de 1, otras 3 de grado 2 y las restantes 3 tenían una puntuación de grado 3. Cuando se aplicó la escala AGM, sólo se verificaron resultados estéticos adversos en una de las pacientes (A2-A3).
Pacientes tratadas con 3D-CRT
Ninguna de las mujeres tratadas con 3D-CRT presentó un eritema superior al grado 1 en la región mamaria. En 3 de las 5 pacientes tratadas con 3D-CRT se observó un puntaje estético final (escala Harvard/NSABP) de 2 puntos, mientras que 2 mujeres evolucionaron con 3 puntos. Cuando aplicamos la escala AGM, ninguna de las participantes presentó deterioro en términos cosméticos.
En forma independiente del tratamiento y de la evolución (control local, fracaso local, efectos adversos agudos de grado 3), todas las pacientes estaban complacidas con la elección de la técnica de retratamiento y sólo una de ellas señaló que no optaría por tratarse nuevamente en otra ocasión, debido a los resultados estéticos de grado 3.
Discusión
Para las pacientes que evolucionan con CM sobre un territorio mamario previamente irradiado, el tratamiento aceptado es la mastectomía de rescate con reconstrucción o sin ella, que se asocia con excelentes tasas locales de recurrencia.5,19,20 La histología del tumor primario o de la recurrencia no parecen generar repercusiones en términos de la opción de rescate. Las pacientes sometidas a una mastectomía de rescate se ven obligadas a optar por una opción mutilante. Aquellas que eligen una cirugía reconstructiva requieren cirugías prolongadas y, en ocasiones, múltiples. Si bien la reconstrucción se asocia con resultados cosméticos aceptables, nunca resultan similares a los de la mama original. Las mujeres en quienes se efectuó una mastectomía, aún con reconstrucción, refieren repercusiones significativas sobre su calidad de vida.6,7 Muchas RICM son lesiones pequeñas al momento de su identificación durante el seguimiento de las mujeres que han padecido un CM, dado que estas pacientes son controladas de modo más meticuloso, por lo cual el umbral de intervención diagnóstica y terapéutica es más reducido.
En un estudio de una cohorte de pacientes con recurrencias, un autor subdividió a las participantes según la histología (invasiva contra no invasiva).21 Virtualmente todas las mujeres con lesiones invasivas iniciales volvieron a presentar este tipo de tumores, mientras que aquellas con una RICM posterior a un tratamiento de preservación para un CDI recurrieron con un nuevo CDI. No se identificaron diferencias en la supervivencia o el control local. En nuestro grupo de pacientes no se advirtió entre patrón de recurrencias. Muchos autores han descrito la presentación sincrónica de RICM con metástasis en otros órganos, la cual se observa en el 5% a 15% de las pacientes.22-24 En estas mujeres se requiere una comparación cuidadosa de la relación entre los riesgos y los beneficios en relación con la calidad y la expectativa de vida, contra la realización de los extensos procedimientos de reconstrucción. Ya que muchas pacientes con CM metastático pueden vivir durante años, la presencia de metástasis no excluye a estas mujeres de la posibilidad de reconstrucción o incluso de repetidos intentos de preservación mamaria.
Opciones aceptadas para la RICM
Repetición de la exéresis quirúrgica. Muchos autores han informado los resultados del tratamiento efectuado sólo con una nueva exéresis. Salvadori y colaboradores señalaron una tasas de recurrencia local posterior a la RICM tratada con nueva exéresis del 19%, en comparación con un 4% en mujeres tratadas con mastectomía de rescate, sin diferencias en la supervivencia libre de enfermedad.25 Otros autores han informado tasas de recurrencia local del 35% en pacientes con RICM posterior a la cirugía de preservación mamaria asociada con radioterapia.22 Los investigadores japoneses del Osaka Medical Center for Cancer and Cardiovascular Diseases efectuaron tratamiento de rescate en 11 mujeres, con repetición de tumorectomía como única terapia en 30 pacientes.26 Nueve de estas 30 enfermas presentaron una segunda recurrencia local dentro de los 3 años. La tasa de supervivencia global a los 5 años fue de 90%.
La repetición de la tumorectomía se asocia con limitaciones. Dado que el volumen del tejido removido se incrementa de forma exponencial con el aumento de los márgenes lineales de resección, el requerimiento marginal puede dar lugar a resultados estéticos subóptimos. Debido a que el volumen se relaciona con el cubo del radio de la cavidad (volumen de una esfera: 4/3 x pi x cubo del radio), las pequeñas diferencias lineales se magnifican en grandes diferencias de volumen. En las pacientes que se someten a resecciones repetidas, incluso los pequeños aumentos volumétricos pueden inducir malos resultados estéticos.
Mastectomía de rescate. El tratamiento convencional de la RICM posterior a una cirugía de preservación mamaria con irradiación es la mastectomía de rescate. En estudios con una cantidad relativamente grande de pacientes con RICM (n > 100), la media de las tasas de fracaso local fue menor de 10%.20,21,25,27,28 Con los avances en las técnicas de reconstrucción como la cirugía oncoplástica y el uso de colgajos, así como con el mayor uso de expansores tisulares e implantes mamarios con siliconas o solución fisiológica, la mastectomía de rescate se considera aún una opción viable.
Repetición de la radioterapia externa. Algunos de los primeros retratamientos de las RICM con radioterapia involucraban la administración de irradiación externa posterior a la cirugía de preservación. En una publicación inicial se informó la supervivencia libre de enfermedad a los 6 años de un caso clínico de RICM tratado mediante exéresis amplia con radioterapia externa postoperatoria.29 En una cohorte con mayor cantidad de pacientes en la universidad de Pittsburgh (Deutsch y colaboradores)30, 39 mujeres evolucionaron con RICM, las que habían sido tratadas originalmente con cirugía de preservación con radioterapia con 4 500 a 5 040 cGy en fracciones de 180 a 200 cGy. Cinco pacientes presentaron márgenes positivos de resección al momento de la nueva irradiación. Estas mujeres recibieron 5 000 cGy adicionales (en fracciones de 200 cGy) de radioterapia externa con fotones o electrones. Ocho pacientes (20.5%) presentaron una segunda RICM; tres de estas recurrencias se ubicaban en el mismo cuadrante mamario que la RICM original. Tanto los médicos tratantes como las enfermas estaban satisfechos con los resultados estéticos.
Braquiterapia como segunda radioterapia. Muchos autores comunicaron resultados del retratamiento con LDR y señalaron tasas aceptables de control local y de resultados cosméticos en pacientes adecuadamente seleccionadas.15,19,31 Chadha y colaboradores publicaron datos sobre el uso de dosis escalonadas y demostraron un control local libre de mastectomía en el 93% de las pacientes (14 de 15 casos) durante una mediana de seguimiento de 36 meses.31 Las primeras 6 mujeres recibieron LDR en una dosis de 3 000 cGy antes de la titulación de la dosis a 4 500 cGy, después de demostrar toxicidad aceptable en la cohorte inicial. Se informó un solo caso de repetición de la recurrencia en una enferma tratada con la dosis inicial de 3 000 cGy. Estos resultados son comparables a los de nuestra cohorte más numerosa y uniforme.
Hannoun-Levi y colaboradores describieron su experiencia con 69 pacientes que evolucionaron con RICM tras la terapia de preservación.32 Veinticuatro mujeres recibieron 30 cGy, mientras que en las restantes mujeres se administró una dosis total sobre el lecho tumoral de 45 a 50 Gy mediante el uso de hilos de iridio 192. Sólo 11 pacientes (16%) presentaron una segunda RICM después de una mediana de seguimiento de 50 meses. Sin embargo, no se clasificaron los resultados estéticos de acuerdo con los criterios de Harvard/NSABP. Las complicaciones a largo plazo incluyeron fibrosis, retracción, telangiectasias o necrosis en 50 pacientes. Los autores señalaron que la tasa de complicaciones de alto grado se incrementaba con la administración de dosis totales (radioterapia externa previa y recurrencias) superior a 100 Gy (4% contra 32.5%; p = 0.005). Además, se describieron tasas más elevadas de recurrencia local en el subgrupo de pacientes con menor dosis total (43.8% contra 5.3%). Ese ensayo incluyó la cohorte más numerosa publicada en la actualidad.
En forma reciente, hemos combinado nuestros datos de tratamiento con LDR con aquellos de los investigadores del Beth Israel Hospital.33 En el análisis de los datos combinados se obtuvo una cohorte numerosa, con tasas de supervivencia libre de mastectomía de 94.4% y de supervivencia global de 87.9% a los 5 años. En nuestra publicación inicial sobre terapia intersticial, se demostró la eficacia y seguridad en una cohorte no aleatorizada de pacientes consecutivas con una media de seguimiento de 35 meses.19 Otros autores han confirmado nuestros resultados con la aplicación de esquemas escalonados de dosificación;31,32 sin embargo, nuestro grupo de LDR constituye la mayor cohorte tratada mediante parámetros uniformes de dosis completas. Nuestros datos obtenidos después de una mediana de seguimiento de 67.5 meses fundamentan la aplicación de la radioterapia con LDR como un tratamiento estandarizado alternativo de las RICM. Existe baja probabilidad de cambios en los resultados estéticos en esta cohorte de tratamiento con LDR, ya que se alcanza estabilidad hacia los 2 a 2.5 años a partir de la braquiterapia, de acuerdo con nuestra experiencia.
La radioterapia indicada como tratamiento para la RICM, en lugar de la nueva exéresis, fue descrita por Petrovich y colaboradores.34 Nueve pacientes definidas por los autores como “no candidatas a la terapia quirúrgica y con pocas probabilidades de beneficiarse de la sola radioterapia” fueron tratadas con la combinación de braquiterapia con LDR e hipertermia intersticial con microondas, con una media de dosis de terapia radiante de 25 a 50 Gy. Siete pacientes experimentaron una respuesta completa, definido como la regresión continua del tumor mantenida por no menos de 30 días. No se determinaron datos significativos en términos de supervivencia en este estudio de fase I-II.
Hannoun-Levi y colaboradores han publicado recientemente sus resultados acerca de la terapia con HDR intersticial.35 Cuarenta y dos pacientes recibieron braquiterapia intersticial con HDR, constituida por 34 Gy en 10 fracciones administradas en 5 días consecutivos. Si bien esa cohorte, fue, en general, de mayor edad que la nuestra (medianas de 65 contra 55 años), el intervalo hasta la aparición de recurrencia desde la finalización de la terapia hasta la aparición de RICM a los 11 años. La tasa de control local fue de 97% después de una mediana de seguimiento de 21 meses. Si bien el período de seguimiento no fue lo suficientemente extenso para validar la estabilidad del control local, se considera apropiado para evaluar los efectos adversos agudos y los resultados estéticos a largo plazo. Los efectos agudos se percibieron como aceptables y tanto el resultado cosmético definido por los médicos como la satisfacción de las pacientes fueron muy elevados.
La braquiterapia con dosis pulsadas (PDR) ha sido mencionada recientemente como retratamiento posterior a la repetición de la tumorectomía.36 Kaumer-Domer y colaboradores informaron 39 casos de terapia ya sea con exéresis amplia (n = 15) o cirugía de preservación tisular (n = 24). Luego de la cirugía, se indicó a todas las pacientes PDR con un total de 50.1 Gy, con dosis fraccionadas de 0.6 a 1.0 Gy (media de 0.8 Gy) en intervalos horarios. La dosis se estimó para un volumen que incluía un margen de 2.0 cm alrededor del lecho tumoral, con la excepción de la piel en un margen no menor de 5 mm desde el implante. Después de una media de seguimiento de 57 meses, la tasa de control local a los 5 años era de 93%. Sólo 24 pacientes se evaluaron en términos de morbilidad, resultados estéticos y calidad de vida; solamente 4 de esas 24 mujeres presentaron efectos adversos tardíos. Los resultados estéticos se clasificaron como excelentes o buenos en el 37% de las mujeres de acuerdo con dos evaluadores independientes, si bien no se especificó la escala cosmética de valoración.
A partir de la aparición de los catéteres de braquiterapia con balón en 2002, comenzamos a utilizar estos equipos en pacientes con RICM y hemos informado nuestros resultados iniciales,37 con expansión de nuestra experiencia junto al uso de 3D-CRT en un estudio posterior.38 Ambas cohortes de pacientes están incluidas en el ensayo combinado antes presentado.
Sobre la base de los primeros datos, el Radiation Therapy Oncology Group (RTOG) ha iniciado el protocolo 1014 para el estudio del retratamiento radiante mamario parcial.39 En este protocolo se aplica 3D-CRT hiperfraccionada, con 4 500 cGy distribuidos en fracciones de 150 cGy en 2 dosis diarias.
Aunque el sistema de puntuación Harvard/NSABP ha sido utilizado en forma tradicional para cuantificar los resultados estéticos posteriores al tratamiento de novo18 (tabla 3), consideramos a esta escala como un método limitado para la descripción cosmética en las pacientes retratadas. Por lo tanto, se elaboró la modificación AGM a partir de los criterios de Harvard19 (tabla 3). Este sistema de puntuación se diferencia de la escala Harvard por la incorporación de un puntaje cosmético inicial previo a la nueva irradiación y de un puntaje final después del segundo procedimiento de conservación; así, el puntaje estético es más preciso para reflejar los efectos cosméticos del retratamiento a largo plazo. La puntuación estética posquirúrgica de novo en nuestra institución es de grado 1 (Harvard/SSABP) después de la tumorectomía inicial. Sin embargo, la degradación de los resultados estéticos en el retratamiento se demostró con mayor certeza mediante la modificación AGM en 6 pacientes. Dado que en 3 mujeres se informó un puntaje estético de 2 puntos y en otras 2 se calculó en 3 puntos (una puntuación de 3 se considera estéticamente regular), la modificación AGM se considera relevante para la evaluación de los resultados cosméticos finales, así como una orientación para la selección de pacientes para el retratamiento. Sugerimos que en las mujeres que se presentan para un nuevo tratamiento de preservación debería proyectarse un puntaje posquirúrgico no mayor de 2 para lograr resultados cosméticos satisfactorios finales. Recomendamos criterios específicos de selección para todas las mujeres en quienes se considera la realización de una segunda tumorectomía y retratamiento radiante. En primer lugar debe evaluarse el estado clínico de la paciente, así como los riesgos y beneficios relativos a la prolongada supervivencia que se espera en estas mujeres, en relación con la expectativa de vida proyectada (en forma dependiente e independiente de la neoplasia). En segundo término, las pacientes deben disponer de adecuado volumen tisular residual para la colocación del implante y demostrar un resultado estético aceptable en la etapa postoperatoria para actuar en caso de una nueva falla quirúrgica. En tercer lugar, recomendamos el retratamiento sólo en enfermas con características tumorales favorables (tamaño tumoral de hasta 2.0 cm, márgenes negativos de resección, ausencia de adenopatías clínicamente aparentes o enfermedad metastática). Finalmente, todas las pacientes deben comprender con claridad que la mastectomía es el tratamiento estandarizado aceptado. Recomendamos la información exhaustiva a todas las mujeres antes de la repetición de la terapia de preservación, pero se debe advertir a todas las pacientes que consultan con un puntaje de Harvard/NSABP no menor a 2 puntos acerca de la posibilidad de un deterioro del resultado cosmético, y acaso exhibir fotografías de enfermas previas con peores resultados estéticos para una mejor comprensión de la posible evolución final. Las pacientes elegidas deben contar con adecuado tejido mamario para la acomodación de los implantes después de la tumorectomía, con preservación cutánea para la ubicación de las semillas al menos 1.0 cm por debajo de la superficie de la piel para los implantes de LDR. Pese a los datos a largo plazo de nuestra cohorte de pacientes tratadas con LDR, preferimos la utilización de balones de HDR, dada su sencillez de uso, la prescripción de dosis focalizadas, la administración de la terapia sin internación y las escasas complicaciones significativas. Aunque la 3D-CRFT parece el método más simple y rentable, con menor necesidad de personal técnico especializado, el volumen de tejido mamario que requiere irradiación debe aumentarse de modo exponencial debido a las restricciones de movimiento, las cuales no se observan con el uso de balones ya que estos dispositivos se encuentran dentro del parénquima mamario.
Conclusiones
La RICM constituye un desafío para pacientes y médicos. Recomendamos la posibilidad de un nuevo intento de preservación mamaria en enfermas adecuadamente seleccionadas con RICM, con el fin de incrementar la autopercepción y la satisfacción de las enfermas. Asimismo, proponemos la utilización de la modificación AGM en las mujeres retratadas para una comunicación más precisa de los resultados estéticos.
|
 Bibliografía del artículo
Bibliografía del artículo
1. Veronesi U, Cascinelli N, Mariani L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 347:1227-32, 2002.
2. Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus radiation for the treatment of invasive breast cancer. N Engl J Med 347:1233-41, 2002.
3. Globocan 2008: http://globocan.iarc.fr/factsheets/cancers/all.asp.
4. Fowble BL, Solin LJ, Schultz DJ, et al. Ten year results of conservative surgery and irradiation for stage I and II breast cancer. Int J Radiat Oncol Biol Phys 21:269-277, 1991.
5. Abner AL, Recht A, Eberlein T, et al. Prognosis following salvage mastectomy for recurrence in the breast after conservative surgery and radiation therapy for early-stage breast cancer. J Clin Oncol 11:44-48, 1993.
6. Ganz P, et al. Breast conservation versus mastectomy; is there a difference in Psychological adjustment or quality of life in the year after surgery? Cancer 69:1729-1738, 1992.
7. Rowland et al. Role of breast reconstruction in physical and emotional outcomes among breast cancer survivors. JNCI 92:1422-1429, 2000.
8. Maunsell E, et al. Psychological distress after initial treatment for breast cancer: a comparison of partial and total mastectomy. J Clin Epidemiol 42:765-771, 1989.
9. Benitez PR, Keisch ME, Vicini F, et al. Five-year results: the initial clinical trial of MammoSite balloon brachytherapy for partial breast irradiation in early stage breast cancer. Am J Surg 194:456-62, 2007.
10. Strnad V, Ott OJ, Hildebrandt G, et al. Partial breast irradiation using multicatheter interstitial brachytherapy for early breast cancer: Results of the German-Austrian multicenter Phase II trial. Brachytherapy 8:107, 2009.
11. King TA, Bolton JS, Kuske RR, et al. Long-term results of wide-field brachytherapy as the sole method of radiation therapy after segmental mastectomy for Tis, 1, 2 breast cancer. Am J Surg 180:299-304, 2000.
12. Polgar C, Fodor J, Major T, et al. Breast-conserving treatment with partial or whole breast irradiation for low-risk invasive breast carcinoma - 5-year results of a randomized trial. Int J Radiat Oncol Biol Phys 69:694-702, 2007.
13. Arthur DW, Winter K, Kuske RR, et al. A phase II trial of brachytherapy alone after lumpectomy for select breast cancer: tumor control and survival outcomes of RTOG 95-17. Int J Radiat Oncol Biol Phys 72:467-73, 2008.
14. Vicini FA, Antonucci V, Wallace M, et al. Long-term efficacy and patterns of failure after accelerated partial breast irradiation: a molecular assay-based clonality evaluation. Int J Radiat Oncol Biol Phys 68:341-6, 2007.
15. Polgar C, Major T, Fodor J, et al. Accelerated partial breast irradiation using high- dose-rate interstitial brachytherapy: 12-year update of a prospective clinical study. Radiother Oncol 94:274-279, 2010.
16. http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcaev3.pdf.
17. NSABP Protocol B-39/ RTOG Protocol 0413. A randomized phase III study of conventional whole breast irradiation (WBI) versus partial breast irradiation (PBI) for women with stage 0, I, or II breast cancer.
18. NSABP Protocol B-39/ RTOG Protocol 0413. A randomized phase III study of conventional whole breast irradiation (WBI) versus partial breast irradiation (PBI) for women with stage 0, I, or II breast cancer; form COS.
19. Trombetta M, Julian TB, Kim Y, et al. The Allegheny General Modification of the Harvard Breast Cosmesis Scale for the Retreated Breast. Oncology 23, 2009.
19. Trombetta M, Julian T, Bhandari T, et al. Breast conservation surgery and interstitial brachytherapy in the management of locally recurrent carcinoma of the breast: The Allegheny General Hospital experience. Brachytherapy 7(1):29-36, 2008.
20. Doyle T, Schultz D, et al. Long-term results of local recurrence after breast conservation treatment for invasive breast cancer. Int J Radiation Oncology Biol Phys 51(1):74-80, 2001.
21. Huang E, Bucholz T, et al. Classifying local disease recurrences after breast conservation therapy based on location and histology. Cancer 95(10):2059-2067, 2002.
22. Kurtz JM, et al. Results of salvage surgery for mammary recurrence following breast conserving therapy. Ann Surg 207:347-351, 1988.
23. Fowble B, Solin L, Schultz D, et al. Breast recurrence following conservation surgery and radiation: Patterns of failure, prognosis, and pathologic findings from mastectomy specimens with implications for treatment. Int J Radiat Oncol Biol Phys 19:833-842, 1990.
24. Haffty BG, Fischer D, Beinfield M, et al. Prognosis following local recurrence in the conservatively treated breast cancer patient. Int J Radiat Oncol Biol Phys 21:293-298, 1991.
25. Salvadori, B, Marubini E et al. Reoperation for locally recurrent breast cancer in patients previously treated with conservative surgery. Br Journ Surg 86:84-87, 1999.
26. Komoike Y, Motomura K, et al. Repeat lumpectomy for patients with ipsilateral breast tumor recurrence after breast conserving surgery. Oncology 64:1-6, 2003.
27. Abner AL, Recht A, Eberlein T, et al. Prognosis following salvage mastectomy for recurrence in the breast after conservative surgery and radiation therapy for early-stage breast cancer. J Clin Oncol 11:44-48, 1993.
28. Cajucom C, Tsangaris T, Nemoto T, et al. Results of salvage mastectomy for local recurrence after breast-conserving surgery without radiation therapy. Cancer 57(5):1174-1779, 1993.
29. Recht A, Schnitt SJ, Connolly JL, et al. Prognosis following local or regional recurrence after conservative surgery and radiotherapy for early stage breast cancer. Int J Radiat Oncol Biol Phys 16:3-9, 1989.
30. Deutsch M. Repeat high-dose external beam irradiation for in-breast tumor recurrence after previous lumpectomy and whole breast irradiation. Int J Radiation Oncology Biol Phys 53(3):687-691, 2002.
31. Chadha M, Feldman S, Boolbol S, et al. The feasibility of a second lumpectomy and beast brachytherapy for localized cancer in a breast previously treated with lumpectomy and radiation therapy for breast cancer. Brachytherapy 7:22-28, 2008.
32. Hannoun-Levi JM, Houvenaeghel G, Ellis S, et al. Partial breast irradiation as second conservative treatment for local breast cancer recurrence. Int J Radiat Oncol Biol Phys 60:1385-92, 2004.
33. Chadha M, Trombetta M, Boolbol S, et al. Management of a small recurrence in the previously irradiated breast; is there a second chance for breast conservation? Oncology 11:933-40, 2009.
34. Petrovich Z, Langholz B, Lam, K, et al. Interstitial microwave hyperthermia combined with Iridium-192 radiotherapy for recurrent tumors. Am J Clin Oncol 12(3):264-268, 1989.
35. Hannoun-Levi J, Castel J, Plesu, A et al. Second conservative treatment for ipsilateral breast cancer recurrence using high-dose rate interstitial brachytherapy: preliminary clinical results and evaluation of patient satisfaction. Brachytherapy 10(3):171-7, 2011.
36. Kauer-Dorner D, et al. Partial breast irradiation for locally recurrent breast cancer within a second breast conserving treatment: Alternative to mastectomy? Results from a prospective trial. Radiother Oncol (2011; E Pub ahead of print).
37. Trombetta M, Julian TB, Miften M, McWilliams W, Kim Y, Parda D. The use of the MammoSite® balloon applicator in re-irradiation of the breast. Brachytherapy 7:316-319, 2008.
38. Trombetta M, Julian TB, Werts ED, Colonias A, Betler J, Kotinsley K, Kim Y, Parda D. Comparison of conservative management techniques in the retreatment of ipsilateral breast tumor recurrence. Brachytherapy 10(1):74-80, 2011.
39. RTOG protocol 1014: A phase II study of repeat breast preserving surgery and 3D- conformal partial breast re-irradiation (PBRI) for local recurrence of breast carcinoma; http://www.rtog.org/ClinicalTrials/ProtocolTable/StudyDetails.aspx?study=1014.
Artículos publicados por el autor
(selección):
Santos R, Colonias A, Parda D, Trombetta M, Maley R, Keenan R, Landreneau R Comparison between sublobar resection and 125 Iodine brachytherapy following sublobar resection in high risk patients with stage I non-small cell lung cancer. Cancer Surgery 134(134):691-697, 2003
Miften M, Werts E, Trombetta M, Fuhrer R, Parda D Tolerance levels for dosimetric IMRT QA based on radiobiological parameters Medicine Physics 32:2039, 2005
Birdas T, Koehler R, Colonias A, Trombetta M, Maley R, Landreneau R, Keenan R Sublobar resection with brachytherapy versus lobectomy for stage IB non-small cell lung cancer. Annals of Thoracic Surgery 81:434-439, 2006
|
|
