EFECTO ANABOLICO OSEO DEL BORTEZOMIB EN UN PACIENTE CON MIELOMA MULTIPLE: COMUNICACION DE UN CASO
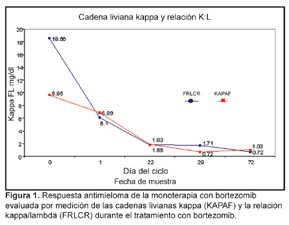
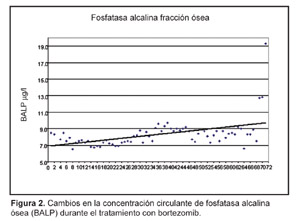
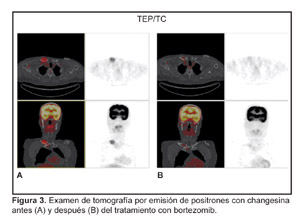
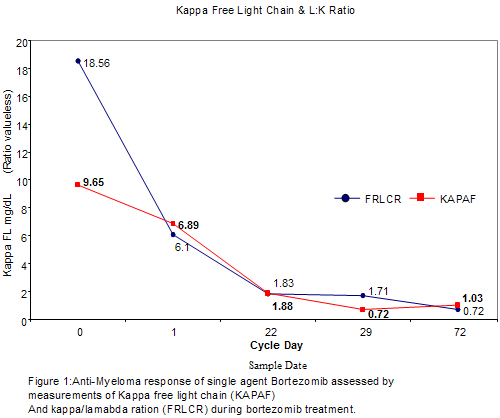
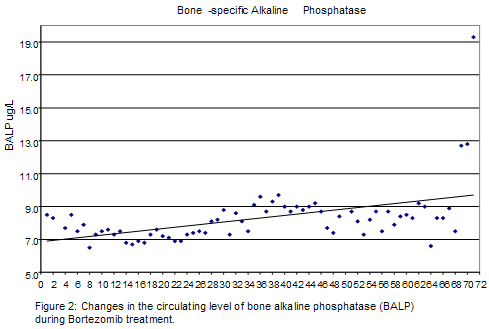
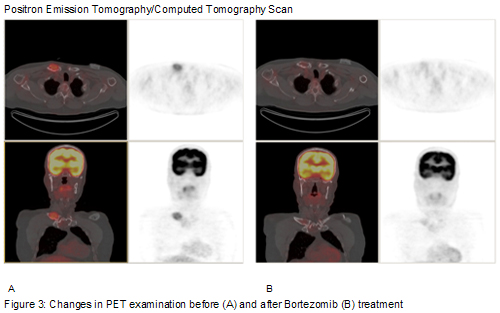
La comunicación de este caso confirma que en los pacientes con mieloma recurrente, la respuesta al agente único bortezomib se asocia a una estimulación espectacular del anabolismo óseo.
Institución del autor
University of Arkansas for Medical Sciences, Little Rock, EE.UU.
Coautores
Federica Cavallo* Larry Suva** Michael Burns*** Guido Tricot**** Shmuel Yaccoby**
MD, University of Torino, Turín, Italia*
PhD, University of Arkansas for Medical Sciences, Little Rock, EE.UU.**
University of Arkansas for Medical Sciences, Little Rock, EE.UU.***
MD, PhD, University of Utah, Salt Lake, EE.UU.****
Primera edición en siicsalud
2 de febrero, 2010