MICOBACTERIOSIS PERITONEAL EN UN PACIENTE CON SINDROME DE INMUNODEFICIENCIA ADQUIRIDA
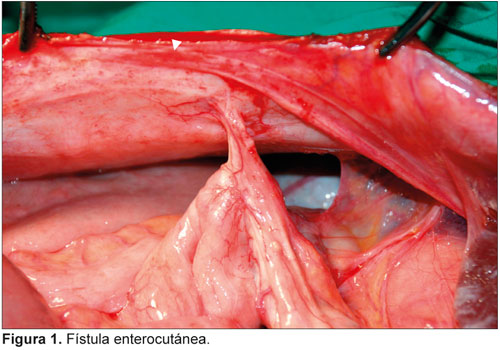
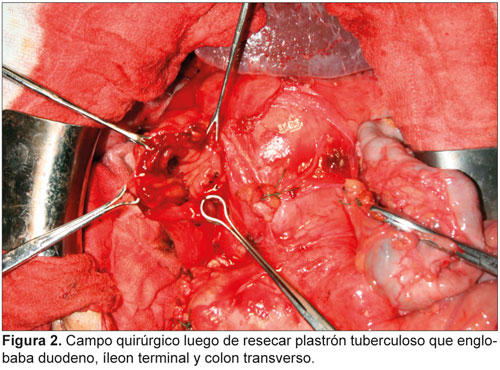
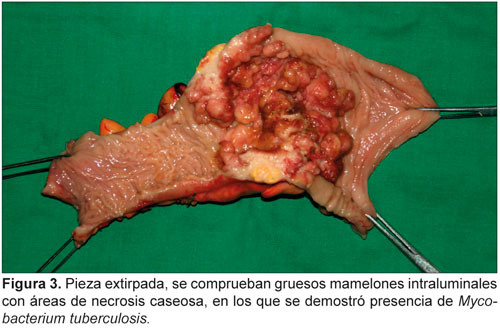
La importancia diagnóstica de este tipo de infección se destaca en este primer caso de micobacteriosis peritoneal e intestinal por Mycobacterium avium-intracellulare en un paciente cubano con el síndrome de inmunodeficiencia adquirida (sida).
Institución del autor
Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba
Coautores
Gilberto Fleites González* Miguel Ángel Acosta Suárez** Jesús Manuel Romero Rodríguez* Lidunka Valdés Alonso*** Reinaldo León Canga**** María Rosarys Martínez Romero***** Raúl Díaz Rodríguez******
Médico Cirujano, Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba*
Médico Angiólogo, Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba**
Médica Gastroenteróloga, Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba***
Médico General Integral, Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba****
Médica en Microbiología, Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba*****
Licenciado en Bioquímica, Instituto de Medicina Tropical Dr. Pedro Kouri, La Habana, Cuba******
Primera edición en siicsalud
30 de noviembre, 2016