|
Coautores
Carolina Andrea Pontillo* Claudia Marcela Cocca** Noelia Victoria Miret* Clara Ventura*** Lorena Vanesa Zárate**** Florencia Ana Chiappini* Laura Alvarez* Diana Leonor Kleiman de Pisarev*****
Bióloga, Universidad de Buenos Aires, Buenos Aires, Argentina*
Bioquímica, Universidad de Buenos Aires, Buenos Aires, Argentina**
Biotecnóloga, Universidad de Buenos Aires, Buenos Aires, Argentina***
Estudiante, Universidad de Buenos Aires, Buenos Aires, Argentina****
Química, Universidad de Buenos Aires, Buenos Aires, Argentina*****
|
|
Recepción del artículo: 13 de abril, 2017
|
|
Aprobación: 9 de enero, 2018
|
 Conclusión breve
Conclusión breve
Las alteraciones en el microambiente estrogénico podrían influir sobre el comportamiento biológico de la glándula mamaria y los tumores, llevando a lesiones preneoplásicas o a un aumento en la malignidad tumoral mamaria.
 Resumen
Resumen
El hexaclorobenceno (HCB) es un contaminante ambiental ampliamente distribuido y un desorganizador endocrino. Su exposición crónica en humanos produce porfiria, síntomas neurológicos, trastornos inmunitarios y disfunciones tiroideas. Es un agonista débil del receptor de hidrocarburos aromáticos (AhR), un factor de transcripción que modula genes relacionados con el metabolismo de xenobióticos, la proliferación, la migración y la invasión. Nuestro objetivo es revisar los efectos del HCB en la glándula mamaria y el cáncer mamario, resumiendo los principales mecanismos de acción. El HCB aumenta el desarrollo tumoral y activa vías de señalización de c-Src/receptor del factor de crecimiento epidérmico (EGFR), mientras que disminuye la fosforilación de tirosina 537/receptor de estrógenos alfa (REalfa), promoviendo un fenotipo de mayor malignidad y metástasis pulmonar en diferentes modelos con animales. En la glándula mamaria de rata genera un microambiente estrogénico por activación del REalfa y las vías de insulina/factores de crecimiento similares a la insulina (IGF). En células de cáncer mamario humanas MCF-7 (REalfa) induce proliferación celular, promoviendo la progresión del ciclo, aumentando la ciclina D1 y la interacción p27/c-Src. En MDA-MB-231 (-REalfa) estimula la migración e invasión, así como la expresión de metaloproteasas y factor de crecimiento transformante beta 1 (TGF-beta 1). Estos estudios indican que las alteraciones en el microambiente estrogénico podrían influir el comportamiento biológico de la glándula mamaria y los tumores, lo que provoca lesiones preneoplásicas o aumento en la malignidad tumoral mamaria. Nuestros hallazgos sugieren que el HCB podría ser un factor de riesgo para la progresión del cáncer de mama humano.
 Palabras clave
Palabras clave
hexaclorobenceno, desorganizador endocrino, cáncer de mama, receptor de hidrocarburos aromáticos, c-src quinasa, metástasis, factor de crecimiento transformante-beta 1
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/153099
Especialidades
 Principal: Oncología, Toxicología,
Principal: Oncología, Toxicología,
 Relacionadas: Bioquímica, Endocrinología y Metabolismo, Salud Ambiental, Salud Pública,
Relacionadas: Bioquímica, Endocrinología y Metabolismo, Salud Ambiental, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
Andrea S. Randi, 1121, Buenos Aires, Argentina
Hexachlorobenzene as a risk factor in breast cancer
 Abstract
Abstract
Hexachlorobenzene (HCB) is a widespread environmental pollutant and an endocrine disruptor. Chronic exposure of humans to HCB elicits porphyria, neurologic symptoms, immune disorders and thyroid dysfunctions. It is a dioxin-like compound and a weak ligand of the AhR (aryl hydrocarbon receptor), a transcription factor that modulates genes related to detoxification, proliferation, migration and invasion. This study was carried out to revise the results of HCB action on mammary gland and breast cancer, summarizing the main ideas of its mechanism of action. HCB increases tumor development and active c-Src/EGFR (epidermal growth factor receptor) signaling pathways, while reducing tyrosine537-ER-alpha (estrogen receptor-alpha) phosphorylation, and promoting a phenotype with enhanced malignancy and lung metastasis in different animal models. In a rat mammary gland, HCB promotes an estrogenic microenvironment by activation of ER-alpha and Insulin/IGFs (insulin growth factors) pathways. HCB induces cell proliferation, promoting cell cycle progression and enhancing cyclin D1 expression and c-Src/p27 interaction in (ER-alpha) MCF-7 human breast cancer cell line. In (ER-alpha)(-) MDA-MB-231 breast cancer cells, the pesticide enhances cell migration and invasion as well as metalloproteases and TGF-beta1 (transformig growth factor-beta1) expression. In conclusion our current study suggests that alterations in the estrogenic microenvironment may influence the biological behavior of mammary gland or breast tumors, leading to preneoplastic lesions or enhanced malignancy, respectively. Our findings suggest that HCB may be a risk factor for human breast cancer progression.
 Key words
Key words
hexachlorobenzene, endocrine disruptor, breast cancer, aryl hydrocarbon receptor, c-src kinase, metastasis, transforming growth factor beta 1
EL HEXACLOROBENCENO COMO FACTOR DE RIESGO EN EL CÁNCER DE MAMA
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Pesticidas organoclorados y riesgo de cáncer mamario
En el transcurso de los últimos 150 años los seres humanos hemos fabricado diversos compuestos químicos para satisfacer las necesidades crecientes de la producción agrícola. Un grupo de estas sustancias químicas son muy resistentes a la degradación, por lo que se los conoce como contaminantes orgánicos persistentes, ya que se insertan en la cadena trófica y suponen un alto riesgo para la salud humana. Entre estas sustancias se encuentran los pesticidas organoclorados, los bifenilos policlorados (PCB, por sus siglas en inglés) y los compuestos tipo dioxina capaces de unirse al receptor de hidrocarburos aromáticos (AhR, por sus siglas en inglés), como la TCDD (2,3,7,8, tetraclorodibenzo-p-dioxina,) y el hexaclorobenceno (HCB). Debido a su estructura, estos compuestos son altamente lipofílicos, se concentran en el tejido adiposo y el suero, atraviesan la placenta y se acumulan en leche materna.1 Algunos de estos compuestos se comportan como desorganizadores endocrinos (DE), ya que interfieren con la síntesis, el metabolismo o la acción de diferentes hormonas.2 Los DE pueden antagonizar o activar la acción de estrógenos por diferentes mecanismos: unión al receptor de estrógenos (RE), alteración de su síntesis modulando la aromatasa o activación de otros factores de transcripción.3-5 Entre los DE encontramos el bifenol A (BPA, por su sigla en inglés), el diclorodifeniltricloroetano (DDT) y el glifosato.
La exposición de poblaciones humanas a los DE altera el desarrollo normal de la glándula mamaria y se considera un factor de riesgo para el cáncer dependiente de hormonas.6 Se estima que más del 80% de casos de cáncer de mama, sin antecedentes familiares, podrían estar asociados con factores ambientales.7 Varios informes han sugerido una asociación directa entre la exposición a compuestos organoclorados y riesgo de cáncer mamario.8 Según otros autores, el análisis de datos de poblaciones humanas fracasa en proveer una evidencia firme de asociación causal entre los niveles de exposición a los DE y el riesgo de cáncer de mama.9 Otros estudios mostraron mayores niveles de pesticidas organoclorados en pacientes con cáncer de mama, en comparación con sujetos sanos.10 Se observó una fuerte asociación entre la incidencia de recidiva de cáncer mamario y altos niveles séricos de p,p-diclorodifenildicloroetileno (DDE) y HCB.11 Asimismo, otros investigadores12 hallaron que el cáncer de mama independiente de estrógenos fue más frecuente en pacientes con mayores niveles de HCB en sus adipocitos. Por otra parte, se observó una correlación positiva entre el riesgo de cáncer de mama y las concentraciones séricas de ß-hexaclorociclohexano (ß-HCH), HCB y PCB.13
En un estudio llevado a cabo en la Argentina, los compuestos más frecuentemente detectados en el tejido adiposo mamario de pacientes con cáncer de mama fueron DDE, HCB y ß-HCH, y se observó una correlación positiva entre los tumores que expresaban el receptor de progesterona (RP) y los niveles de organoclorados en el tejido adiposo adyacente.14 También se informó una asociación positiva entre las concentraciones de HCB en adipocitos y marcadores pronósticos tumorales como RE y RP, y una asociación negativa con cadherina E y p53.15 Sin embargo, en un estudio realizado en Japón no se observó aumento del riesgo de cáncer mamario en mujeres con altos niveles de organoclorados en suero.16
El HCB es un contaminante ambiental ampliamente distribuido y si bien su uso como fungicida fue prohibido en la Argentina en el año 2000, actualmente se libera al ambiente como subproducto de procesos de cloración.17 La principal fuente de exposición global de la población humana es a través del consumo de alimentos contaminados, como productos lácteos, pescados y carne. Además, también puede tener lugar a través de la inhalación de aire contaminado, por contacto dérmico, exposición en el útero o a través de la lactancia.18 Una vez absorbido, por su característica lipofílica, el HCB se distribuye en órganos y tejidos con alto contenido lipídico, como glándula mamaria, hígado, tiroides, tejido adiposo y ovarios.19 En un estudio reciente, de 2016, se encontró HCB en el aire cercano a la costa del Océano Atlántico, en la provincia de Buenos Aires.20 En otro trabajo publicado en 2017, se informó que el HCB fue el segundo organoclorado más frecuente en suero de puérperas en Ushuaia, Argentina (8.7 ng de HCB/g de grasa).21 Situaciones similares se registran en otros países del mundo, ya que se detectó HCB en el suero de cordón umbilical y en el suero materno en poblaciones de China,22 así como en el suero de residentes en Francia23 y en Italia.24 Es importante destacar que los niveles de organoclorados acumulados en el tejido graso implican que el individuo ha estado expuesto a lo largo de su vida, pudiendo o no estarlo al momento de la toma de la muestra. Sin embargo, los niveles de organoclorados existentes en el suero, indican una contaminación cercana al momento de la toma de la muestra. La exposición crónica al HCB se considera un problema de salud pública, debido a que se asocia con efectos adversos como síntomas neurológicos,25 trastornos inmunitarios26 y disfunciones tiroideas.27 Asimismo, el HCB ha sido clasificado como probable carcinógeno humano.28 Es por ello que la regulación de esta sustancia por parte de los organismos gubernamentales es importante para la protección de la salud humana, de todos los organismos vivientes y del medio ambiente en general.
Mecanismo de acción de los compuestos tipo dioxina
El HCB es un tóxico tipo dioxina debido a que presenta afinidad por el receptor AhR, se acumula en los tejidos grasos y estimula la expresión de enzimas que detoxifican xenobióticos.29 Debido a su lipofilicidad, estos contaminantes atraviesan las membranas y dentro de las células los tóxicos se unen al AhR que se encuentra en el citosol formando un complejo con la c-Src quinasa y proteínas chaperonas. Una vez unido (tóxico-AhR), se desencadenan dos posibles caminos: uno de membrana y otro nuclear. En el camino de membrana, se libera y activa la proteína c-Src, que estimula receptores de factores de crecimiento (RFC).30 La c-Src es un protooncogén implicado en el desarrollo de diferentes tipos de cáncer humano.31 Por otro lado, en el camino nuclear, el complejo tóxico-AhR transloca el núcleo, modulando la expresión de genes implicados en el metabolismo de xenobióticos, proliferación, migración, invasión y angiogénesis.32,33
Efectos del HCB en la glándula mamaria
La glándula mamaria atraviesa distintas etapas de remodelación en su desarrollo. En ratones, el desarrollo de este órgano comienza en el embrión, donde se forma una glándula rudimentaria con los primeros conductos. Luego, estos se invaginan para dar lugar a las yemas terminales (TEB, por sus siglas en inglés). En la pubertad, por la acción de los estrógenos, a partir de las TEB los conductos mamarios continúan ramificándose hasta formar la glándula mamaria completa. Durante el embarazo se incrementa aun más la ramificación de los conductos. Al final de la preñez y durante la lactancia, por acción de la progesterona y la prolactina, se forman los alvéolos mamarios en el extremo de cada conducto que tiene el epitelio secretor.34 Este proceso está orquestado por hormonas, como estrógenos, progesterona y prolactina, y factores de crecimiento, como el IGF-1 (factor de crecimiento tipo 1 similar a la insulina), el EGF (factor de crecimiento epidérmico) y el TGF-ß1 (factor de crecimiento transformante ß1). A su vez, las metaloproteasas (MMP) degradan la matriz extracelular permitiendo la migración de células epiteliales para formar nuevos conductos mamarios. La glándula mamaria madura está compuesta de dos compartimentos celulares: un epitelio dinámico que atraviesa ciclos de proliferación, diferenciación y apoptosis en respuesta a las señales locales y endocrinas, y un estroma adyacente compuesto de fibroblastos, células endoteliales y adipocitos.34
En estos últimos años se ha observado que muchos pesticidas sintéticos, detergentes y cosméticos que se han convertido en contaminantes ambientales, alteran la función endocrina.35 En particular, los compuestos organoclorados, a pesar de tener una afinidad relativamente baja por el RE, presentan una potente actividad endocrina. Esto se debe a su gran concentración en tejido adiposo mamario, dada por su alta lipofilicidad y resistencia a la biodegradación. Por otro lado, los xenoestrógenos pueden promover patologías reguladas por estrógenos36 al modular los niveles de hormonas o alterar el mecanismo de los receptores.3 Al respecto, en nuestro laboratorio hemos observado que el tratamiento de ratas Sprague-Dawley con HCB (100 mg/kg p.c.) durante 45 días, produce cambios en la morfología de la mama normal, induciendo hiperplasia celular en los lóbulos e incrementando el número de conductos mamarios.37 Estas alteraciones histológicas se podrían asociar con el incremento en la activación y en la expresión proteica de receptores de IGF-1 y de insulina, encontrados en las mismas muestras de glándulas mamarias expuestas al pesticida.37 Se ha informado que tanto el receptor de IGF-1 como el de insulina estimulan la proliferación de células normales y neoplásicas de glándula mamaria.38,39 En estudios de otro grupo de investigación, se observó un aumento en la expresión de la Akt y una reducción en los niveles de conexina 43 (Cx43) en células de glándula mamaria de ratas expuestas en forma crónica al HCB. Por otra parte, en ensayos in vitro, los mismos autores comunicaron que el tratamiento de células de mama humanas MCF-12A con HCB durante siete días, activó la Akt pero no produjo cambios en la Cx43.40 Las conexinas forman canales intercelulares que unen el citoplasma de dos células adyacentes, permitiendo la transferencia de iones y pequeñas moléculas. Debido a su importancia para mantener las funciones celulares, la perturbación en la expresión de conexinas está involucrada en la etiología y progresión del cáncer.41
Numerosos trabajos realizados con células de cáncer de mama muestran que la expresión de Cx43 está disminuida.42 Asimismo, la hiperactivación del camino de señalización de fosfoinositol 3 kinasa (PI3K)/Akt fue identificada como un fuerte contribuyente a la tumorigénesis en diferentes tipos de cáncer, como el de glándula mamaria.43 Asimismo, en otro estudio con ratas expuestas al HCB (100 mg/kg p.c.), nuestros resultados mostraron un incremento en el número de TEB y encélulas estromales (hipercelularidad del estroma) de la glándula mamaria.44 conductoEstas alteraciones fueron acompañadas por un aumento en la activación de la c-Src quinasa y del receptor de factor de crecimiento epidérmico (EGFR) y por la interacción física entre estas dos moléculas y, además, por la interacción entre c-Src y el receptor de estrógenos alfa (REa), que lleva a su activación.44 Se ha comunicado que el REa es activado por la proteína quinasa c-Src en ratones, y esta activación es requerida para desencadenar la síntesis de ADN y el crecimiento tumoral.45 Además, el EGFR estimula el crecimiento y la progresión tumoral porque activa diferentes caminos de señalización asociados con la proliferación, angiogénesis, invasión y metástasis.46 Los resultados obtenidos avalan la hipótesis de que el HCB genera un microambiente estrogénico que puede alterar el desarrollo normal de la glándula mamaria, al activar la vía del Rea, así como de receptores de factores de crecimiento como el de IGF-1, la insulina y el EGFR, desencadenando la aparición de lesiones preneoplásicas, que son consideradas estructuras premalignas y precursores de lesiones neoplásicas.
Las investigaciones acerca del AhR comenzaron debido a su papel en los efectos tóxicos de contaminantes ambientales, descubriéndose más tarde su importancia en funciones fisiológicas normales, como el desarrollo embrionario, la regulación del ciclo celular y la respuesta inmunitaria.47,48 A su vez, otros investigadores demostraron que la inactivación de dicho receptor impide el desarrollo normal de la glándula mamaria y, por lo tanto, la lactancia.49 Tomando en cuenta estos antecedentes, nos propusimos realizar ensayos con ratones C57/B16 +/+ y -/- para el AhR, y exponerlos al HCB (3 mg/kg p.c.) durante 21 días, debido a que la pubertad es el momento clave cuando tienen lugar la mayoría de las alteraciones en la morfogénesis mamaria.50 Demostramos claramente que el tratamiento con HCB incrementa la hiperplasia ductal, la proliferación celular, la localización nuclear del REa, la densidad de la ramificación de los conductos mamarios, y el número de TEB.51 Observamos también que los ratones AhR-/- conductopresentaban hiperplasia ductal y un aumento en el tamaño de la mama, en ausencia del tratamiento con HCB. Dichos resultados podrían estar relacionados con la reducción de los niveles de expresión del AhR en las células epiteliales mamarias AhR+/+ tratadas con el pesticida, informados en ese mismo trabajo.51 Estos resultados apoyan la idea de que el AhR juega un papel clave como inhibidor de la proliferación en la glándula mamaria normal.49 La evidencia acumulada ha demostrado que la interacción entre las células epiteliales y el estroma es crítico en el desarrollo de la glándula mamaria.50 En el estroma tumoral los fibroblastos adquieren un fenotipo activado, que puede ser identificado por alta expresión de la proteína alfa-actina de músculo liso (a-SMA).52 En ese mismo estudio, observamos que la exposición al HCB (0.05 µM) induce migración en células epiteliales de glándula mamaria de ratón NMuMG. Asimismo, el HCB (5 µM) incrementa el contenido de a-SMA en los fibroblastos de glándula mamaria, transformándolos hacia un fenotipo activado encontrado en el estroma de cáncer de mama. Ambos efectos del pesticida fueron dependientes de la presencia del AhR. Por lo tanto, demostramos que concentraciones ambientalmente relevantes de HCB in vivo (3 mg/kg p.c.) e in vitro (0.05-5 µM) modulan las vías de señalización del AhR y del TGF-ß1, que pueden contribuir a alterar la morfogénesis de la glándula mamaria, llevando a la adquisición de lesiones preneoplásicas.51 (Figura 1A y B).
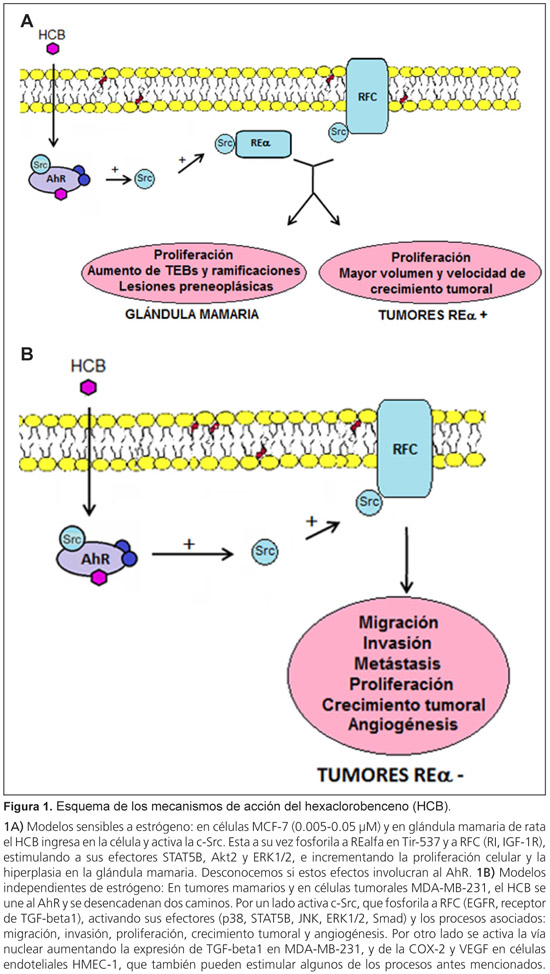
Acciones del HCB en tumores de mama y células de carcinoma mamario en etapas iniciales
El cáncer de mama es la enfermedad neoplásica más común en las mujeres y comprende más de una tercera parte de todos los nuevos casos de cáncer detectados en las mujeres de las sociedades occidentales. Asimismo, se presenta como la primera causa de muerte por tumores entre las mujeres.53 conductoEn la Argentina se producen 5600 muertes por año por cáncer de mama, y luego de Uruguay, nuestro país es el lugar de América con la tasa de mortalidad más alta por cáncer de mama.54 Los tumores mamarios se clasifican según factores histológicos y clínicos, tales como el tamaño, el grado tumoral, su estadio y su capacidad de formar metástasis en los ganglios linfáticos. A su vez, se clasifican inmunohistoquímicamente por la expresión de marcadores como el RE, el receptor de progesterona (RP), el EGFR y el EGFR2/HER-2/ErB2. Generalmente, los tumores RE+ y RP+ tienen un buen pronóstico ya que responden a la terapia hormonal; mientras que los tumores mamarios RE-, RP-, HER-2- (triple negativos) que suelen sobreexpresar el EGFR, no responden a la terapia hormonal y presentan un peor pronóstico al tener una alta tasa proliferativa y mayor capacidad metastásica.55
En nuestro laboratorio hemos estudiado en profundidad las acciones del HCB en el cáncer de mama. En un primer estudio, in vivo, usamos un modelo de ratas Sprague-Dawley tratadas con N-nitroso N-metilurea (NMU), un carcinógeno que induce tumores mamarios que expresan RE+, RP+ y EGFR+. La administración de HCB (100 mg/kg p.c.) durante 45 días sin la inyección previa de NMU, no generó tumores mamarios. Las ratas previamente tratadas con NMU fueron expuestas al HCB (grupo NMU-HCB), y encontramos un incremento en la incidencia tumoral, en el volumen y velocidad de crecimiento tumoral, así como en el número de tumores por rata. A su vez, el tratamiento con HCB aumentaba la atipia celular en los tumores mamarios de ratas NMU-HCB respecto de los de las ratas NMU.37 Estas observaciones demuestran que el HCB tiene un efecto cocarcinogénico junto con el NMU. En otro estudio más reciente, demostramos que en los tumores de ratas NMU-HCB, el tóxico estimula la vía de señalización de c-Src/EGFR, pero disminuye la actividad del Rea, transformando los tumores hacia un fenotipo de mayor malignidad.44 Seguidamente, con el objetivo de estudiar el efecto directo del pesticida sobre las células de carcinoma mamario, expusimos la línea celular de cáncer de mama humano MCF-7 (REa+) a diferentes dosis de HCB (0.005-5 µM). Las células MCF-7 representan un modelo tumoral en las primeras etapas de desarrollo, dependiente de hormonas, no metastásico. Demostramos que el tóxico tiene efecto estrogénico en dosis bajas (0.005-0.05 µM) al activar el REa, llevando a la estimulación de la vía del receptor de IGF-1 y a la proliferación celular.56 Recientemente, profundizamos sobre el efecto estrogénico del HCB en células MCF-7, al demostrar que el tóxico estimula la proliferación modulando el ciclo celular.57
Se sabe que los estrógenos producen una amplia gama de efectos biológicos y son un fuerte estímulo para la proliferación celular en la glándula mamaria. A su vez, la acción estrogénica es responsable de la progresión de células en el ciclo celular para su pasaje de la fase G1 a la S, ingresando de esa manera en la duplicación del ADN.58 Las ciclinas y las CDK (kinasas dependientes de ciclinas) regulan el ciclo celular. Estas proteínas están reguladas por inhibidores específicos, tales como la p27. Luego de una señal antimitogénica, la proteína p27 se une al complejo ciclina D1-CDK4 para inhibir su actividad catalítica, evitando la entrada al ciclo celular.59 Al respecto, en nuestro trabajo observamos que la exposición de células MCF-7 a dosis bajas de HCB (0.005 µM) activa la c-Src quinasa, la cual se asocia con p27, evitando su translocación al núcleo, y con ello promueve el aumento de la ciclina D1 que estimula el pasaje a la fase S del ciclo celular.57 Estos últimos resultados demuestran que el HCB, en dosis bajas, actúa como un xenoestrógeno en las fases tempranas del cáncer de mama, favoreciendo la proliferación celular y con ello el crecimiento tumoral al activar el REa y la c-Src quinasa. Además, a las mismas dosis incrementa la expresión de los receptores de IGF-1 y de insulina (Figura 1).
Efectos del HCB en tumores mamarios y células de cáncer de mama en etapas avanzadas
Se conoce que los pacientes con cáncer, en general, no mueren por el tumor primario, sino por la aparición de las metástasis que se generan a partir de éste. conductoEs por ello que nos resultó fundamental estudiar la acción de la exposición al pesticida en esta etapa de la progresión tumoral. De esta manera, utilizamos la línea celular de cáncer de mama humano MDA-MB-231, que no expresa el REa y sobreexpresa el EGFR, representando un tumor de mama más avanzado, con características metastásicas. Durante la progresión tumoral, las células epiteliales se desprenden del tumor primario, se adhieren e invaden el estroma adyacente y atraviesan los vasos sanguíneos para luego, eventualmente, formar tumores secundarios o metástasis. Las MMP son una familia de endopeptidasas que al degradar la matriz extracelular desempeñan un papel protagónico en los procesos de invasión y metástasis.60 Las gelatinasas A (MMP2) y B (MMP9) están asociadas con el incremento de la malignidad de la célula tumoral porque son las únicas capaces de degradar el colágeno de tipo IV que forma parte de la membrana basal.61 Al respecto, demostramos que la exposición de células MDA-MB-231 al HCB (0.005, 0.05, 0.5 y 5 µM) aumenta la expresión y activación de la c-Src quinasa y el EGFR.62 Además, observamos que el pesticida induce la migración e invasión celular, aumentando los niveles y actividad de MMP2 y MMP9. Además, encontramos que el AhR, la c-Src quinasa y el EGFR estuvieron involucrados en estos procesos desencadenados por el pesticida.62,63 Seguidamente nos planteamos evaluar si el tóxico podría alterar la metástasis, usando diferentes modelos con animales para cáncer de mama, expuestos al HCB (0.3, 3 y 30 mg/kg p.c.) durante treinta días. Utilizamos un modelo espontáneo, inoculando tumores mamarios C4-HI (RE+ y RP+) en ratones, y observando las metástasis que se desprenden desde el tumor primario, hacia pulmones e hígado, por histología. Luego, un modelo experimental, inoculando células de carcinoma mamario LM3 (RE-, RP-) en la vena de la cola de ratones y analizando las metástasis pulmonares en forma macroscópica. Encontramos que el tratamiento de los ratones con HCB incrementa el crecimiento tumoral y las metástasis pulmonar y hepática, favoreciendo la progresión tumoral.63
En la literatura se ha descripto que el TGF-ß1 participa en el desarrollo del cáncer.64 El TGF-ß1 suele tener un efecto antiproliferativo en la mayoría de las células epiteliales y en estadios tempranos del tumor, mientras que acelera la progresión tumoral y metástasis en los estadios avanzados del cáncer.65 Los altos niveles de TGF-ß1 en las células tumorales se correlacionan con un mayor riesgo de metástasis y mal pronóstico.66 El TGF-ß1 es secretado por las células tumorales y se une a su receptor, desencadenando dos tipos de vías de señalización: la de los Smad o canónica y las vías no canónicas (MAPK).66,67 Los caminos de señalización celulares del TGF-ß1 y del AhR interactúan entre sí, regulando las proteínas del ciclo celular.68 Otros autores han demostrado que el TGF-ß1 desencadena efectos específicos sobre el AhR, inhibiendo la expresión y activación de este receptor en células de carcinoma pulmonar, mientras que aumenta la función en células de hepatoma.69 Asimismo, el análisis en sistemas celulares y modelos con animales nulos para el AhR, ha demostrado que este receptor es relevante para mantener la actividad del TGF-ß1. En otro orden, la sobreexpresión de esta proteína podría tener un papel en producir algunos fenotipos identificados en ratones con AhR disminuido.70 Dado que previamente observamos que el HCB induce migración e invasión en las células MDA-MB-231, seguidamente nos propusimos estudiar la acción del pesticida en la interacción entre las vías del AhR y del TGF-ß1 en esta línea celular. Los resultados mostraron que a cortos tiempos de exposición (5 a 30 min), el HCB se une al AhR y estimula a la c-Src quinasa, la cual activa el receptor de TGF-ß1 desencadenando tanto las vías canónicas (Smad) y no canónicas (MAPK). Mientras que en tiempos más largos (2 a 6 horas), el HCB se une al AhR y luego se transloca al , donde induce la expresión del TGF-ß1, que se secreta al medio y se une a su receptor, activándolo. También se demostró que la activación de la vía del TGF-ß1 por el HCB desencadena un aumento en la migración e invasión, llevando a la línea celular a un fenotipo de mayor malignidad.71
La angiogénesis es el proceso fisiológico por el cual se forman nuevos vasos sanguíneos a partir de vasos preexistentes, y es primordial en algunas patologías como el cáncer, tanto para el crecimiento como para la progresión.72 Durante la angiogénesis tumoral, las células epiteliales, estromales y endoteliales secretan factores angiogénicos como el factor de crecimiento endotelio vascular (VEGF), que se une a su receptor de tipo 2 (VEGFR-2) en las células endoteliales. Esto desencadena la activación del endotelio vascular al inducir su capacidad de proliferar, migrar e invadir para poder formar nuevos vasos sanguíneos.73 Existen varios estudios acerca de los mecanismos involucrados en el proceso de angiogénesis tumoral, en algunos de los cuales participan moléculas clave como el TGF-ß, la c-Src quinasa, las especies reactivas del oxígeno y la ciclooxigenasa 2 (COX-2).74 Tomando en cuenta los estudios previos de nuestro laboratorio, donde habíamos observado que la exposición al HCB favorece el crecimiento tumoral y las metástasis, nos propusimos examinar la acción del tóxico sobre la angiogénesis. Utilizamos un modelo in vivo, con ratones expuestos al HCB (0.3, 3 y 30 mg/kg p.c.) durante treinta días, que luego fueron inoculados con células MDA-MB-231 (REa-) en ambos cordones mamarios para evaluar el switch angiogénico. Esta es una fase prevascular durante el desarrollo tumoral temprano, donde muy pocas células tumorales son angiogénicas. Como todos los tumores sólidos están neovascularizados en el momento en que se detectan, nos resultó interesante poder evaluar el efecto del pesticida justamente en este paso del desarrollo tumoral. Nuestros resultados mostraron que el HCB estimula la angiogénesis, incrementando la densidad de los microvasos en la zona de inoculación de las células, y la expresión del VEGF in vivo.75 Por otro lado, evaluamos in vitro, en células microvasculares endoteliales de mama humana HMEC-1, la acción del HCB (0.005, 0.05, 0.5 y 5 µM) sobre la expresión de diferentes factores proangiogénicos, la migración y la formación de túbulos. Observamos que el tóxico promueve un aumento en la expresión de la COX-2 y en la secreción de VEGF involucrando al AhR, y activa el VEGFR-2 en células endoteliales HMEC-1. También demostramos que la exposición al HCB activa dicha línea celular endotelial incrementando su migración y la formación de túbulos de manera dependiente del AhR, la COX-2 y el VEGFR-2.75 Teniendo en cuenta nuestros resultados, en ese estudio hipotetizamos que la exposición al HCB, activa el AhR induciendo la expresión de COX-2. A su vez, la COX-2 estimula la expresión de VEGF que luego, al ser secretado, se une su receptor VEGFR-2 en la célula endotelial, activándola y permitiendo así la formación de nuevos vasos sanguíneos (Figura 1B).
En nuestros ensayos in vitro empleamos dosis de HCB de 0.005, 0.05, 0.5 y 5 µM. Otros autores informaron niveles de HCB en suero humano de 32 ng/ml, que equivalen a 1.1 µM.76 Asimismo, el límite máximo residual permitido en frutas y verduras, según las directivas de la Comisión Europea es de 0.01 µM. Para los ensayos in vivo, en nuestros primeros trabajos con ratas usamos 100 mg/kg p.c. de HCB; sin embargo, en los siguientes disminuimos las concentraciones de HCB considerablemente para ser comparables con las exposiciones ambientales. En un ensayo realizado con ratas con 500 mg/kg p.c. de HCB por vía oral, la concentración medida de HCB en suero fue de 600 ng/ml,77 por lo cual la concentración interna de HCB en nuestras ratas podría ser de 120 ng/ml, mientras la comunicada en suero humano por To Figueras y colaboradores es de 32 ng/ml.76 En otro trabajo los niveles de HCB en el suero de puérperas fueron de 70.62 ng/g de lípido.22 Recientemente usamos dosis de HCB de 0.3, 3, 30 mg/kg p.c., ya que otros investigadores emplearon 5 mg/kg p.c. en ratones, y observaron efectos androgénicos.78 Por otra parte, las dosis empleadas en nuestros estudios son similares a las encontradas en muestras de suero de diferentes poblaciones humanas.22,24
Conclusiones y perspectivas
En nuestro laboratorio hemos estudiado exhaustivamente los efectos de la exposición al HCB en la glándula mamaria y en diferentes estadios del cáncer de mama. En resumen, nuestros resultados convergen en que la exposición a concentraciones ambientalmente relevantes de HCB contribuyen a alterar la morfogénesis de la glándula mamaria, llevando a la adquisición de lesiones preneoplásicas. Por otra parte, los numerosos ensayos realizados con diferentes modelos de cáncer de mama in vitro e in vivo nos llevan a concluir que la exposición al tóxico favorece la progresión tumoral, tanto en etapas tempranas (dependientes de hormonas) promoviendo la proliferación, como en etapas tardías (independientes de las hormonas) estimulando la migración, la invasión, la angiogénesis y la metástasis. Por lo tanto, nuestros hallazgos sugieren que la exposición al HCB podría ser un factor de riesgo para la progresión del cáncer de mama humano. Sería fundamental llevar a cabo estudios epidemiológicos para evaluar si lo observado a nivel experimental está ocurriendo en diferentes poblaciones humanas. Un dato relevante de algunos estudios es la detección de HCB en una gran proporción de muestras humanas, tales como tejido adiposo mamario, suero de puérperas y de cordón umbilical, así como leche materna. Del análisis de estos resultados se pone de manifiesto la baja adhesión a las normas, la persistencia de pesticidas organoclorados en la cadena alimentaria y la relevancia del problema, aun cuando el uso de un compuesto se encuentra prohibido. De esta manera, se debería tomar con mayor seriedad y compromiso las decisiones de políticas públicas de control con respecto al uso de sustancias con consecuencias adversas sobre la salud humana y el medio ambiente.
 Bibliografía del artículo
Bibliografía del artículo
1. Van den Berg M, Birnbaum L, Bosveld AT y col. Toxic equivalency factors (TEFs) for PCBs, PCDDs, PCDFs for humans and wildlife. Environ Health Perspect 106:775-792, 1998.
2. Waring RH, Harris RM. Endocrine disrupters-a threat to women's health? Maturitas 68:111-115, 2011.
3. Li Y, Luh CJ, Burns KA y col. Endocrine-disrupting chemicals (EDCs): in vitro mechanism of estrogenic activation and differential effects on ER target genes. Environ Health Perspect 121:459-466, 2013.
4. Inoshita H, Masuyama H, Hiramatsu Y. The different effects of endocrine disrupting chemicals on estrogen receptor-mediated transcription through interaction with coactivator TRAP220 in uterine tissue. J Mol Endocrinol 31:551e561, 2003.
5. Fan W, Yanase T, Morinaga H y col. Herbicide atrazine activates SF-1 by direct affinity and concomitant co-activators recruitments to induce aromatase expression via promoter II. Biochem Biophysical Res Commun 355:1012e1018, 2007.
6. Pelekanou V, Leclercq G. Recent insights into the effect of natural and environmental estrogens on mammary development and carcinogenesis. Review Int J Dev Biol 55:869-878, 2011.
7. Safe S. Clinical correlates of environmental endocrine disruptors. Trends Endocrinol Metab 16:139-144, 2005.
8. Aronson KJ, Miller AB, Woolcott CG y col. Breast adipose tissue concentrations of polychlorinated biphenyls and other organochlorines and breast cancer risk.Cancer Epidemiol Biomarkers Prev 9:55-63, 2000.
9. Calle EE, Frumkin H, Henley SJ, Savitz DA, Thun MJ. Organochlorines and breast cancer risk. CA Cancer J Clin 52:301-9, 2002.
10. Charlier CJ, Albert AI, Zhang L, Dubois NG, Plomteux GJ. Polychlorinated biphenyls contamination in women with breast cancer. Clin Chim Acta 347:177-81, 2004.
11. Charlier CJ, Dejardin MTC. Increased risk of relapse after breast cancer with exposure to organochlorine pollutants. Bull Environ Contam Toxicol 78:1-4, 2007.
12. Ociepa-Zawal M, Rubis B, Wawrzynczak D, Wachowiak R, Trzeciak WH. Accumulation of environmental estrogens in adipose tissue of breast cancer patients. J Environ Sci Health ATox Hazard Subst Environ Eng 45:305-12, 2010.
13. Arrebola JP, Belhassen H, Artacho-Cordón F y col. Risk of female breast cancer and serum concentrations of organochlorine pesticides and polychlorinated biphenyls: a case-control study in Tunisia. Sci Total Environ 520:106-13, 2015.
14. Muñoz de Toro M, Durando M, Beldoménico PM y col. Estrogenic microenvironment generated by organochlorine residues in adipose mammary tissue modulates biomarker expression in ER alpha-positive breast carcinomas. Breast Cancer Res 8:R47, 2006.
15. Arrebola JP, Fernández-Rodríguez M, Artacho-Cordón F y col. Associations of persistent organic pollutants in serum and adipose tissue with breast cancer prognostic markers. Sci Total Environ 566-567:41-9, 2016.
16. Itoh H, Iwasaki M, Hanaoka T y col. Serum organochlorines and breast cancer risk in Japanese women: a case-control study. Cancer Causes Control 20:567-80, 2009.
17. Polder A, Skaare JU, Skjerve E, Løken KB, Eggesbø M. Levels of chlorinated pesticides and polychlorinated biphenyls in Norwegian breast milk (2002-2006), and factors that may predict the level of contamination. Sci Tot Environ 407:4584-4590, 2009.
18. Reed L, Buchner V, Tchounwou PB. Environmental toxicology and health effects associated with hexachlorobenzene exposure. Rev Environ Health 22:213-43, 2007.
19. Van Raaij JA, Frijters CM, Van den Berg KJ. Hexachlorobenzene-induced hypothyroidism. Involvement of different mechanisms by parent compound and metabolite. Biochem Pharmacol 46:1385-1391, 1993.
20. Pegoraro CN, Harner T, Su K, Chiappero MS. Assessing levels of POPs in air over the South Atlantic Ocean off the coast of South America. Sci Total Environ 15:571:172-177, 2016.
21. Bravo N, Hansen S, Økland I y col. Influence of maternal and sociodemographic characteristics on the accumulation of organohalogen compounds in Argentinian women. The EMASAR study. Environ Res 158:759-767, 2017.
22. Guo H, Jin Y, Cheng Y y col. Prenatal exposure to organochlorine pesticides and infant birth weight in China. Chemosphere 110:1-7, 2014.
23. Saoudi A, Fréry N, Zeghnoun A y col. Serum levels of organochlorine pesticides in the French adult population: the French National Nutrition and Health Study (ENNS), 2006-2007. Sci Total Environ 472:1089-1099, 2014.
24. Mrema EJ, Rubino FM, Mandic-Rajcevic S y col. Exposure to priority organochlorine contaminants in the Italian general population. Part 1. Eight priority organochlorinated pesticides in blood serum. Hum Exp Toxicol 32:1323-1339, 2013.
25. Kyriklaki A, Vafeiadi M, Kampouri M y col. Prenatal exposure to persistent organic pollutants in association with offspring neuropsychological development at 4years of age: The Rhea mother-child cohort, Crete, Greece. Environ Int 97:204-211, 2016.
26. Gascon M, Sunyer J, Martínez D y col. Persistent organic pollutants and children's respiratory health: the role of cytokines and inflammatory biomarkers. Environ Int 69:133-40, 2014.
27. Llop S, Murcia M, Alvarez-Pedrerol M y col. Association between exposure to organochlorine compounds and maternal thyroid status: Role of the iodothyronine deiodinase 1 gene. Environ Int 104:83-90, 2017.
28. Agency for Toxic Substances and Disease Registry (ATSDR). Toxicological Profile for Hexachlorobenzene. U.S.D.O.H.A.H., Services, Atlanta, GA, 2002.
29. Hahn ME, Goldstein JA, Linko P, Gasiewicz TA. Interaction of hexachlorobenzene with the receptor for 2,3,7,8- tetrachlorodibenzo-p-dioxin in vitro and in vivo. Evidence that hexachlorobenzene is a weak Ah receptor agonist. Arch Biochem Biophys 270:344-355, 1989.
30. Park S, Dong B, Matsumura F. Rapid activation of c-Src kinase by dioxin is mediated by the Cdc37-HSP90 complex as part of Ah receptor signaling in MCF10A cells. Biochemistry 46:899-908, 2007.
31. Frame MC. Src in cancer: deregulation and consequences for cell behaviour. Biochim Biophys 1602:114-130, 2002.
32. Matsumura F. How important is the protein phosphorylation pathway in the toxic expression of dioxin-type chemicals? Biochem Pharmacol 48:215-24, 1994.
33. Roman AC, Carvajal-Gonzalez JM, Rico-Leo EM, Fernandez-Salguero PM. Dioxin receptor deficiency impairs angiogenesis by a mechanism involving VEGF-A depletion in the endothelium and transforming growth factor-beta overexpression in the stroma. J Biol Chem 284:25135-25148, 2009.
34. Ingthorsson S, Briem E, Bergthorsson JT, Gudjonsson T. Epithelial plasticity during human breast morphogenesis and cancer progression. J Mammary Gland Biol Neoplasia 21:139-148, 2016.
35. Frye CA, Bo E, Calamandrei G y col. Endocrine disrupters: a review of some sources, effects, and mechanisms of actions on behaviour and neuroendocrine systems. J Neuroendocrinol 24:144-159, 2012.
36. Shanle EK, Xu W. Endocrine disrupting chemicals targeting estrogen receptor signaling: identification and mechanisms of action. Chem Res Toxicol 24:6-19, 2011.
37. Randi AS, Cocca C, Carbone V y col. Hexachlorobenzene is a tumor co-carcinogen and induces alterations in insulin-growth factors signaling pathway in the rat mammary gland. Toxicol Sci 89:83-92, 2006.
38. Frittitta L, Vigneri R, Papa V, Goldfine ID, Grasso G, Trischitta V. Structural and functional studies of insulin receptors in human breast cancer. Breast Cancer Res Treat 25:73-82, 1993.
39. Surmacz E, Guvakova MA, Nolan MK, Nicosia RF, Sciacca L. Type I insulin-like growth factor receptor function in breast cancer. Breast Cancer Res Treat 47:255-267, 1998.
40. Delisle A, Ferraris E, Plante I. Chronic exposure to hexachlorobenzene results in down-regulation of connexin 43 in the breast. Environ Res 143:229-240, 2015.
41. Grek CL, Rhett JM, Bruce JS, Ghatnekar GS, Yeh ES. Connexin 43, breast cancer tumor suppressor: Missed connections? Cancer Lett 374:117-126, 2016.
42. McLachlan E, Shao Q, Wang HL, Langlois S, Laird DW. Connexins act as tumor suppressors in three-dimensional mammary cell organoids by regulating differentiation and angiogenesis. Cancer Res 66:9886-9894, 2006.
43. Carmona FJ, Montemurro F, Kannan S y col. AKT signaling in ERBB2-amplified breast cancer. Pharmacol Ther 158:63-70, 2016.
44. Peña D, Pontillo C, García MA y col. Alterations in c-Src/HER-1 and estrogen receptor signaling pathways in mammary gland and tumors of hexachlorobenzene treated rats. Toxicology 293:68-77, 2012.
45. Varricchio L, Migliaccio A, Castoria G y col. Inhibition of estradiol receptor/Src association and cell growth by an estradiol receptor alpha tyrosine phosphorylated peptide. Mol Cancer Res 5:1213-1221, 2007.
46. Sebastian S, Settleman J, Reshkin SJ, Azzariti A, Bellizzi A, Paradiso A. The complexity of targeting EGFR signaling in cancer: from expression to turnover. Biochim Biophys Acta 1766:120-139, 2006.
47. Murray IA, Patterson AD, Perdew GH. Ah receptor ligands in cancer: friend and foe. Nat Rev Cancer 14:801-814, 2014.
48. Safe S, Lee S, Jin U. Review role of the aryl hydrocarbon receptor in carcinogenesis and potential as a drug target Toxicol Sci 135:1-16, 2013.
49. Hushka LJ, Williams JS, Greenlee WF. Characterization of 2,3,7,8-tetrachlorodibenzofuran- dependent suppression and AH receptor pathway gene expression in the developing mouse mammary gland. Toxicol Appl Pharmacol 152:200-210, 1998.
50. Sternlicht MD. Key stages in mammary gland development: the cues that regulate ductal branching morphogenesis. BCR 8:201, 2006.
51. Miret N, Rico-Leo E, Pontillo C, Zotta E, Fernández-Salguero P, Randi AS. A dioxin-like compound induces hyperplasia and branching morphogenesis in mouse mammary gland, through alterations in TGF-ß1 and aryl hydrocarbon receptor signaling. Toxicol Appl Pharmacol 3334:192-206, 2017.
52. Kalluri R, Zeisberg M. Fibroblasts in cancer. Nat Rev Cancer 6:392-401, 2006.
53. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin 65:87-108, 2015.
54. INC. Cáncer de mama en Argentina. Instituto Nacional del Cáncer, Ministerio de Salud, Presidencia de la Nación, Buenos Aires, Argentina (http://www.msal.gov.ar/inc/acerca-del-cancer/cancer-de-mama), 2017.
55. Kao J, Salari K, Bocanegra M y col. Molecular profiling of breast cancer cell lines defines relevant tumor models and provides a resource for cancer gene discovery. Plos One 4:e6146, 2009.
56. García MA, Peña D, Alvarez L y col. Hexachlorobenzene induces cell proliferation and IGF-I signaling pathway in an estrogen receptor alpha-dependent manner in MCF-7 breast cancer cell line. Toxicol Lett 192:195-205, 2010.
57. Ventura C, Núñez M, Gaido V y col. Hexachlorobenzene alters cell cycle by regulating p27-cyclinE-CDK2 and c-Src-p27 protein complexes. Toxicol Lett 270:72-79, 2017.
58. Castoria G, Giovannelli P, Lombardi M y col. Tyrosine phosphorylation of estradiol receptor by Src regulates its hormone-dependent nuclear export and cell cycle progression in breast cancer cells. Oncogene 31:4868-4877, 2012.
59. Coqueret O. New roles for p21 and p27 cell-cycle inhibitors: a function for each cell compartment? Trends Cell Biol 13:65-70, 2003.
60. Duffy MJ, Maguire TM, Hill A, Mc Dermott E, O'Higgins N. Metalloproteinases: role in breast carcinogenesis, invasion and metastasis. Rev Breast Cancer Res 2:252-257, 2000.
61. Li H, Qiu Z, Li F, Wang C. The relationship between MMP-2 and MMP-9 expression levels with breast cancer incidence and prognosis. Oncol Lett 14:5865-5870, 2017.
62. Pontillo CA, García MA, Peña D y col. Activation of c-Src/HER1/STAT5b and HER1/ERK1/2 signaling pathways and cell migration by hexachlorobenzene in MDA-MB-231 human breast cancer cell line. Toxicol Sci 120:284-296, 2011.
63. Pontillo CA, Rojas P, Chiappini F y col. Action of hexachlorobenzene on tumor growth and metastasis in different experimental models. Toxicol Appl Pharmacol 268:331-342, 2013.
64. Moses H, Barcellos-Hoff MH. TGF b biology in mammary development and breast cancer. Cold Spring Harb Perspect Biol 3:a003277, 2011.
65. Humbert L, Neel JC, Lebrun JJ. Targeting TGF-beta signaling in human cancer therapy. Trends Cell MolBiol 5:69-107, 2010.
66. Tan AR, Alexe G, Reiss M. Transforming growth factor-beta signaling: emerging stem cell target in metastatic breast cancer? Breast Cancer Res Treat 115:453-495, 2009.
67. Massagué J, Seoane J, Wotton D. Smad transcription factors. Genes Dev 19:2783-2810, 2005.
68. Haarmann-Stemmann T, Bothe H, Abel J. Growth factors, cytokines and their receptors as downstream targets of aryl hydrocarbon receptor (AhR) signaling pathways. Biochem Pharmacol 77:508-520, 2009.
69. Wolff S, Harper PA, Wong JM, Mostert V, Wang Y, Abel J. Cell-specific regulation of human aryl hydrocarbon receptor expression by transforming growth factor ß-1. Mol Pharmacol 59:716-724, 2001.
70. Gómez-Durán A, Carvajal-González JM, Mulero-Navarro S, Santiago-Josefat B, Puga A, Fernández-Salguero PM. Fitting a xenobiotic receptor into cell homeostasis: how the dioxin receptor interacts with TGFbeta signaling. Biochem Pharmacol 77:700-712.
71. Miret N, Pontillo C, Ventura C y col. Hexachlorobenzene modulates the crosstalk between the aryl hydrocarbon receptor and transforming growth factor-ß1 signaling, enhancing human breast cancer cell migration and invasion. Toxicology 366:20-31, 2016.
72. Filho AL, Lopes JM, Schmitt FC. Angiogenesis and breast cancer. J of Oncology pii: 576384, 2010.
73. Koch S, Tugues S, Li X, Gualandi L, Claesson-Welsh L. Signal transduction by vascular endothelial growth factor receptors. Biochem J 437:169-183, 2011.
74. Timoshenko AV, C Chakraborty, GF Wagner, PK Lala. COX-2-mediated stimulation of the lymphangiogenic factor VEGF-C in human breast cancer. British J Cancer 94:1154-1163, 2006.
75. Pontillo C, Español A, Chiappini F y col. Hexachlorobenzene promotes angiogenesis in vivo, in a breast cancer model and neovasculogenesis in vitro, in the human microvascular endothelial cell line HMEC-1. Toxicol Lett 239:53-64, 2015.
76. To Figueras J, Sala M, Otero R y col.Metabolism of hexachlorobenzene in humans: association between serum levels and urinary metabolites in a highly exposed population. Environ Health Perspect 105:78-83, 1997.
77. Chiappini F, Alvarez L, Lux-Lantos V, Randi AS, Kleiman de Pisarev DL. Hexachlorobenzene triggers apoptosis in rat thyroid follicular cells. Toxicol Sci 108:301-310, 2009.
78. Ralph JL, Orgebin-Crist MC, Lareyre JJ, Nelson CC. Disruption of androgen regulation in the prostate by the environmental contaminant hexachlorobenzene. Environ Health Perspect 111:461-466, 2003.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|




