|
 |
 |
Autor:
Gradilone, Sergio A
Columnista Experto de SIIC
Institución:
Instituto de Fisiología Experimental
Consejo Nacional de Investigaciones Científicas y Técnicas (IFISE-CONICET)
Facultad de Ciencias Bioquímicas y Farmacéuticas
Universidad Nacional de Rosario
Santa Fé, Argentina
Artículos publicados por Gradilone, Sergio A |
Coautores
Flavia Isabel Carreras* Guillermo Luis Lehmann** Raúl Alberto Marinelli***
Licenciada en BiotecnologíaInstituto de Fisiología Experimental (IFISE-CONICET). Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario.*
Médico. Instituto de Fisiología Experimental (IFISE-CONICET). Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario.**
Instituto de Fisiología Experimental (IFISE-CONICET). Facultad de Ciencias Bioquímicas y Farmacéuticas. Universidad Nacional de Rosario.***
|
|
Recepción del artículo: 14 de septiembre, 2004
|
|
Aprobación: 12 de octubre, 2004
|
 Conclusión breve
Conclusión breve
La expresión de AQP8 hepática se encuentra disminuida en el modelo experimental de colestasis extrahepática obstructiva, lo cual sugiere que las AQP están además involucradas en los mecanismos de disfunción secretora biliar.
 Resumen
Resumen
El agua es el principal componente de los fluidos biológicos. Sin embargo, los mecanismos moleculares de su transporte a través de las membranas celulares permanecieron ocultos hasta el descubrimiento del primer canal proteico específico para el agua. Estos canales, denominados aquaporinas (AQP), conforman una familia de proteínas homólogas –ampliamente distribuidas en los seres vivos– que facilitan el movimiento de agua a través de las membranas biológicas. Los hepatocitos, células formadoras de la secreción biliar canalicular, expresan tres miembros de esta familia: AQP0, AQP8 y AQP9. Las AQP 0 y 9 se localizan constitutivamente en vesículas intracelulares y en la membrana basolateral, respectivamente. Por su parte, la AQP8 se localiza predominantemente en vesículas intracelulares y se transloca hasta la membrana canalicular en respuesta a la hormona glucagón o a su mensajero intracelular AMPc. Esta redistribución induce un aumento de la permeabilidad de membrana al agua, promueve la secreción de bilis y sugiere una función central de las AQP en la formación de bilis. La expresión de AQP8 hepática se encuentra disminuida en el modelo experimental de colestasis extrahepática obstructiva, lo cual sugiere que las AQP están además involucradas en los mecanismos de disfunción secretora biliar.
 Palabras clave
Palabras clave
Aquaporinas, secreción biliar, tráfico vesicular, transporte de agua, glucagón
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/70151
Especialidades
 Principal: Bioquímica, Gastroenterología,
Principal: Bioquímica, Gastroenterología,
 Relacionadas: Medicina Interna,
Relacionadas: Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Raúl Alberto Marinelli. Suipacha 570. 2000 Rosario. Santa Fe. Argentina Marinelli, Raúl Alberto
ROLE OF AQUAPORIN WATER CHANNELS IN BILE SECRETION
 Abstract
Abstract
Water is the major component of biological fluids. However, the molecular mechanisms underlying its transport through the cellular membranes remained unclear until the first water-selective protein channel was identified. These channels, named aquaporins (AQP), conform a family of integral membrane proteins broadly distributed among living organisms and facilitate the water movement across biological membranes. Hepatocytes, the cells that form the canalicular bile secretion, express three members of the AQP family: AQP0, AQP8 y AQP9. AQP 0 and 9 are constitutively localized in intracellular vesicles and basolateral membranes, respectively. On the other hand, AQP8 is predominantly located in intracellular vesicles but redistributes to the canalicular membrane upon stimulation with the hormone glucagon or its second messenger, cAMP. This redistribution leads to an increased hepatocyte membrane water permeability and induces bile secretion, suggesting a central role of AQP in bile formation. Hepatocyte AQP8 expression was found to be downregulated in the experimental model of extrahepatic obstructive cholestasis, suggesting that AQP are also involved in the mechanisms of bile secretory dysfunction.
 Key words
Key words
Aquaporins, bile secretion, vesicle trafficking, water transport, glucagon
FUNCION DE LAS AQUAPORINAS EN LA SECRECION BILIAR
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Transporte de agua: las aquaporinas
El agua es el principal componente de todos los organismos vivientes. El mecanismo de transporte de las moléculas de agua a través de las membranas celulares fue tema de debate durante décadas. En 1992, el laboratorio del Dr. Peter Agre (Johns Hopkins University, EE.UU.) descubrió y clonó una proteína integral de la membrana de los glóbulos rojos de 28 kDa de peso molecular, logrando así la identificación del primer canal proteico de agua y el final de las controversias.1,2 Estos canales fueron denominados aquaporinas (AQP) y le significaron el premio Nobel de Química 2003 a su descubridor. Actualmente se acepta que el agua puede atravesar las membranas celulares tanto a través de la bicapa lipídica como a través de las AQP.3
Las células que expresan AQP en sus membranas tienen una permeabilidad osmótica al agua muy superior a aquella anticipada por su composición lipídica, ya que aquellas facilitan el movimiento de agua acoplado a gradientes osmóticos generados por el transporte de solutos. Las AQP son una familia de proteínas homólogas ampliamente distribuidas en mamíferos, plantas y organismos inferiores. Las AQP están conformadas por homotetrámeros, cuyos monómeros funcionan como canales independientes. Cada monómero, compuesto por aproximadamente 270 aminoácidos, tiene extremos carboxilo y amino terminales intracelulares y seis dominios transmembrana. De los cinco segmentos conectores de los dominios transmembrana, dos contienen una secuencia de aminoácidos sumamente conservada (Asn-Pro-Ala) que es esencial en la formación del canal de agua (figura 1).3,4
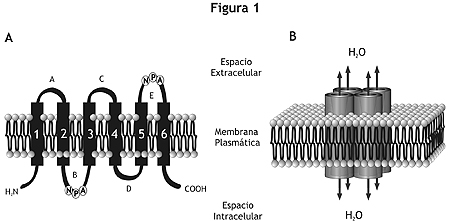
Figura 1. Topología de membrana y organización de las aquaporinas. A: Los monómeros que componen las AQP están constituídos por seis dominios transmembrana. De los cinco segmentos conectores (A-E), dos contienen la secuencia altamente conservada Asn-Pro-Ala (NPA). Los extremos carboxilo y amino-terminal se encuentran orientados hacia el interior celular. B: Las subunidades se organizan en un complejo homotetramérico, quedando los cuatro poros centrales configurados por las asas B y E.En los mamíferos hasta el momento se conocen once AQP, clasificadas en dos subgrupos: las "aquaporinas" (AQP0, AQP1, AQP2, AQP4, AQP5, AQP6 y AQP8) y las "aquagliceroporinas" (AQP3, AQP7, AQP9, AQP10) que además de agua, transportan glicerol y ciertos solutos pequeños.3,4
Algunas AQP, en determinadas células, se localizan en vesículas intracelulares y su tráfico hasta la membrana plasmática es regulado por hormonas. En estos casos, la relevancia fisiológica de las AQP parece residir principalmente en proveer a la célula de un mecanismo para controlar su permeabilidad al agua a través de la regulación del número de moléculas de AQP presentes en la membrana. El caso más estudiado es el de la AQP2 en las células epiteliales del túbulo colector renal, regulada por la hormona antidiurética o vasopresina.5,6
Secreción biliar canalicular
En el hombre, el hígado secreta aproximadamente 600 a 800 ml de bilis por día, proceso que cumple un papel central en un amplio rango de funciones fisiológicas, tales como la absorción intestinal de nutrientes y la excreción de endobióticos y xenobióticos.7
El hígado tiene dos tipos de células epiteliales: los hepatocitos y los colangiocitos. Los hepatocitos elaboran la secreción biliar primaria o canalicular que posteriormente es modificada en volumen y composición por los colangiocitos durante su pasaje por el tracto biliar. Los hepatocitos, como todas las células epiteliales, presentan especializaciones de membrana funcionalmente divididas en un domino basolateral o sinusoidal en contacto con la sangre y uno apical o canalicular en contacto con la bilis. Estas regiones de membrana contienen diferentes sistemas de transporte que determinan el movimiento vectorial de solutos y agua desde la sangre sinusoidal hasta la bilis, contribuyendo así a la formación de ésta.
La secreción biliar canalicular es un proceso osmótico cuya fuerza impulsora se origina por el transporte activo de solutos, principalmente sales biliares, bicarbonato y glutatión. Estos compuestos osmóticamente activos se transportan y concentran en el lumen canalicular induciendo de esta manera un flujo de agua predominantemente por la vía transcelular.7 La hormona glucagón estimula la secreción biliar uniéndose a su receptor específico en la membrana basolateral del hepatocito. El efecto colerético del glucagón es mediado por AMP cíclico e involucra la secreción activa de bicarbonato.8,9
Expresión de AQP en el hígado de rata y regulación de la permeabilidad al agua
En recientes estudios en colaboración con el laboratorio del Dr. Nicholas F. LaRusso (Mayo Clinic and Foundation, EE.UU.) demostramos que los hepatocitos expresan al menos tres AQP (AQP0, AQP8 y AQP9) que podrían contribuir al movimiento transcelular de agua.10-14 Los estudios bioquímicos (fraccionamiento subcelular e inmunoblotting) y morfológicos (inmunohistoquímica e inmunofluorescencia confocal) indican que la AQP8 y la AQP0 se localizan principalmente en el interior de la célula en un compartimento vesicular, mientras que la AQP9 se localiza principalmente sobre la membrana basolateral.10,11
El glucagón o su segundo mensajero, el AMP cíclico, induce la redistribución de AQP8 desde su localización intracelular hacia la membrana plasmática, específicamente hacia el dominio apical.10-14 Por otro lado, la localización subcelular de AQP9 y AQP0 parece ser constitutiva, es decir que no se regula hormonalmente.11 Nuestros estudios funcionales sobre hepatocitos aislados muestran que la redistribución de AQP8 hacia la membrana plasmática va acompañada de un aumento en la permeabilidad osmótica al agua de ésta, lo que indica la inserción de canales funcionales que podrían contribuir al transporte transcelular de agua durante la formación de la bilis. Mas aun, el uso de inhibidores de aquaporinas bloquea tanto el aumento de la permeabilidad de la membrana del hepatocito como la secreción biliar inducida por el colerético.10-14 Nuestros datos indican también que la translocación de AQP8 hacia la membrana plasmática es mediada por un mecanismo dependiente de la proteína quinasa A (PKA) y de los microtúbulos.13 En conjunto, estos estudios proveen sólida evidencia experimental que sustenta un modelo de trabajo en el cual la AQP8 parece cumplir un papel fundamental en la formación de la secreción biliar canalicular inducida por coleréticos (figura 2).
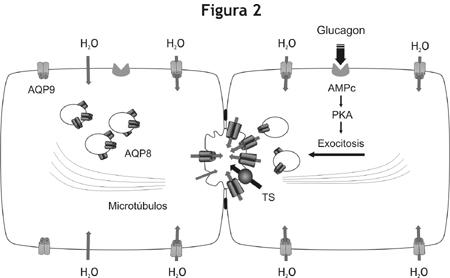
Figura 2. Mecanismos propuestos para el transporte de agua en los hepatocitos. A la izquierda se ilustra un hepatocito en estado basal. La AQP9 se expresa en la membrana basolateral, mientras que la AQP8 se expresa en la membrana canalicular y en vesículas intracelulares. El dominio canalicular posee menor permeabilidad al agua que el basolateral, el primero es limitante para el transporte transcelular de agua. A la derecha se ilustra un hepatocito sujeto a estímulo hormonal. Luego de la unión con su receptor, el glucagón activa la proteína quinasa A (PKA) vía AMPc, lo cual a su vez induce la translocación mediada por microtúbulos de las vesículas conteniendo AQP8. De este modo, la inserción de AQP8 aumenta la permeabilidad canalicular al agua. La activación de transportadores de solutos (TS), como el intercambiador aniónico AE2, generan la fuerza osmótica necesaria para el transporte de agua hacia la luz canalicular.Fisiopatología
La colestasis extrahepática es una condición patológica causada por la obstrucción mecánica de los conductos biliares extrahepáticos que lleva al daño funcional de los hepatocitos con la consiguiente disminución de la formación de bilis canalicular. El modelo experimental aceptado es la rata con ligadura del conducto biliar.15,16
Nuestros estudios muestran que la colestasis extrahepática produce importante disminución en la expresión proteica de AQP8.15 También se vio que la colestasis extrahepática altera la translocación de AQP8 inducida por AMPc hacia la membrana plasmática.15 Además de sustentar nuestra hipótesis sobre la función de la AQP8 en la secreción canalicular de agua, estos resultados sugieren que tanto la expresión defectuosa como la translocación alterada contribuyen a la generación de la disfunción secretoria biliar del hígado colestásico.
Conclusiones y perspectivas
Los mecanismos de secreción y absorción de los solutos generadores de las fuerzas osmóticas impulsoras de los movimientos de agua fueron ampliamente estudiados y caracterizados en diversos epitelios.17-20 Por el contrario, los mecanismos moleculares determinantes de los movimientos de agua fueron sólo parcialmente comprendidos antes del descubrimiento de las AQP. A partir de ese momento, las AQP mostraron ser piezas clave en los procesos de secreción y absorción de fluidos en las distintas barreras epiteliales del organismo.3,21-26
En el caso particular de la secreción biliar, estudios fisiológicos y fisiopatológicos de las AQP hepáticas de rata sugieren que éstas podrían cumplir un papel central en los mecanismos de formación de la bilis.3,10-15 Por ejemplo, en los colangiocitos, células formadoras de la secreción biliar ductular, se describió que el canal de agua AQP1 colocaliza en vesículas intracelulares con el transportador de solutos AE2 (intercambiador Cl-/HCO3-) y el canal de cloruro CFTR (cystic fibrosis transmembrane regulator).27 De esta manera, se conforma una unidad secretora que, frente al estímulo de la hormona secretina, se inserta en la membrana apical y aumenta tanto la secreción de los solutos osmóticamente activos como la permeabilidad al agua de la membrana plasmática. En consecuencia, el transporte de solutos y el de agua quedan temporal y espacialmente acoplados.
Sobre la base de nuestros resultados, es tentador especular con la existencia de un mecanismo similar en la secreción biliar generada por los hepatocitos (figura 2). Es motivo de futuros trabajos investigar sobre la colocalización de la AQP8 con los distintos transportadores de solutos involucrados en la generación de la bilis canalicular, tales como AE2, Mrp2 (proteína asociada a resistencia a multidrogas 2) y Bsep (bomba exportadora de sales biliares). En concordancia con esta hipótesis, se describió que el glucagón produce la inserción y activación en la membrana apical del transportador AE2 y que el estímulo con AMP cíclico produce la inserción de Mrp2 y Bsep.8,28
Los autores no manifiestan conflictos.
 Bibliografía del artículo
Bibliografía del artículo
- Denker BM, Smith BL, Kuhajda FP y col. Identification, purification, and partial characterization of a novel Mr 28,000 integral membrane protein from erythrocytes and renal tubules. J Biol Chem 1988; 263:15634-15642.
- Preston GM, Carroll TP, Guggino WB y col. Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Science 1992; 256:385-387.
- Masyuk AI, Marinelli RA, LaRusso NF. Water transport by epithelia of the digestive tract. Gastroenterology 2002; 122:545-562.
- Agre P, Kozono D. Aquaporin water channels: molecular mechanisms for human diseases. FEBS Letters 2003; 555:72-78.
- Knepper MA, Inoue T. Regulation of aquaporin-2 water channel trafficking by vasopressin. Curr Opin Cell Biol 1997; 9:560-564.
- Nielsen S, Kwon TH, Frokiaer J y col. Key roles of renal aquaporins in water balance and water-balance disorders. News Physiol Sci 2000; 15:136-143.
- Fitz JG. Cellular mechanisms of bile secretion. En Hepatology. A textbook of Liver Disease. Editores, Zakin y Boyer. 1995; 362-376.
- Alvaro D, Della Guardia P, Bini A y col. Effect of glucagón on intracellular pH regulation in isolated rat hepatocytes couplets. J Clin Invest 1995; 96:665-675.
- Lee J, Boyer JL. Molecular alterations in hepatocytes transport mechanisms in acquired cholestatic liver disorders. Semin Liver Dis 2000; 20:373-384.
- García F, Kierbel A, Larocca MC y col. The water channel aquaporin-8 is mainly intracellular in rat hepatocytes and its plasma membrane insertion is stimulated by cyclic AMP. J Biol Chem 2001; 276:12147-12152.
- Huebert RC, Splinter PL, García F y col. Expression and localization of aquaporin water channels in rat hepatocytes. J Biol Chem 2002; 277:22710-22717.
- Gradilone SA, Ochoa JE, García F y col. Hepatocyte membrane water permeability measured by silicone layer filtering centrifugation. Anal Biochem 2002; 302:104-107.
- Gradilone SA, García F, Huebert RC y col. Glucagón induces the plasma mambrane insertion of functional aquaporin-8 water channels in isolated rat hepatocytes. Hepatology 2003; 37:1435-1441.
- Marinelli RA, Tietz PS, Caride AJ, y col. Water transporting properties of hepatocyte basolateral and canalicular plasma membrane domains. J Biol Chem 2003; 278:43157-43162.
- Carreras FI, Gradilone SA, Mazzone A y col. Rat hepatocyte aquaporin-8 water channels are down-regulated in extrahepatic cholestasis. Hepatology 2003; 37:1026-1033.
- Trauner M, Arrese M, Soroka CJ y col. The rat canalicular conjugate export pump (Mrp2) is down-regulated in intrahepatic and obstructive cholestasis. Grastroenterology 1997; 113:255-264.
- Kipp H, Arias IM. Intracellular trafficking and regulation of canalicular ATP-binding cassette transporters. Semin Liver Dis 2000; 20:339-351.
- Häussinger D, Schmitt M, Weiergräber O y col. Short-Term regulation of canalicular transport Semin Liver Dis 2000; 20:307-321.
- Berry CA, Rector FC, Jr. Renal transport of glucose, amino acids, sodium, chloride and water. En The kidney, ed 4. Editores, Brenner BM y Rector FC Jr,: Philadelphia, 1991, WB Saunders Co.
- Cook DI. Secretion by the major salivary glands. En Physiology of the gastrointestinal tract, ed 3. Editores, Johnson LR, New York, 1994, Raven press.
- Nielsen S, Chou CL, Marples D y col. Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channels to plasma membrane. Proc natl Acad Sci USA 1995; 92:1013-1017.
- Ma T, Verkman AS. Aquaporin water channels in gastrointestinal physiology. J Physiol 1999; 517:317-326.
- Ishikawa Y, Ishida H. Aquaporin water channel in salivary glands. Jpn J Pharmacol. 2000; 83:95-101.
- Hamann S. Molecular mechanisms of water transport in the eye. Int Rev Cytol. 2002; 215:395-431.
- Borok Z, Verkman AS. Lung edema clearance: 20 years of progress: invited review: role of aquaporin water channels in fluid transport in lung and airways. J Appl Physiol. 2002; 93:2199-206.
- Portincasa P, Moschetta A, Mazzone A y col. Water handling and aquaporins in bile formation: recent advances and research trends. J Hepatol 2003; 39:864-874.
- Tietz P, Marinelli RA, Chen XM y col. Agonist-induced coordinated trafficking of functionally related transport proteins for water and ions in cholangiocytes. J Biol Chem 2003; 278:20413-20419.
- Misra S; Varticovski L; Arias I. Mechanisms by which cAMP increases bile acid secretion in rat liver and canalicular membrane vesicles. Am J Physiol 2003; 285:G316-G324.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|




