|
Coautores
Isaac Túnez Fiñana. Doctor en Medicina y Ciru* María del Carmen Muñoz de Agueda. Diplomada U*
*
|
|
Recepción del artículo: 27 de abril, 2004
|
|
Aprobación: 10 de , 2004
|
 Conclusión breve
Conclusión breve
Estos datos sugieren la importancia del estrés oxidativo en el modelo del ácido ocadaico, así como su participación en los cambios bioquímicos originados en el curso y evolución de este modelo experimental, similar a la enfermedad de Alzheimer
 Resumen
Resumen
El presente trabajo, realizado en células de neuroblastoma N1E-115, evalúa el estrés oxidativo inducido por ácido ocadaico, peróxido de hidrógeno y ácido ocadaico más peróxido de hidrógeno, así como el efecto protector de la melatonina. Nuestro estudio muestra que la exposición de las células al ácido ocadaico (50 nM) y peróxido de hidrógeno (200 μM) durante dos horas induce un intenso estrés oxidativo caracterizado por descenso en el contenido de GSH y reducción en la actividad celular de glutatión transferasa y catalasa. Asimismo, estas condiciones experimentales desencadenan un incremento en los productos de lipoperoxidación. El grado de estrés oxidativo inducido por el ácido ocadaico casi se duplica en presencia de peróxido de hidrógeno. Los efectos inducidos por el ácido ocadaico, el peróxido de hidrógeno y el ácido ocadaico más peróxido de hidrógeno son evitados por la presencia de melatonina (10-5 M). Estos datos sugieren la importancia del estrés oxidativo en el modelo del ácido ocadaico, así como su participación en los cambios bioquímicos originados en el curso y evolución de este modelo experimental, similar a la enfermedad de Alzheimer. Estos resultados parecen indicar el efecto antioxidante y protector de la melatonina.
 Palabras clave
Palabras clave
Células N1E-115, enfermedad de Alzheimer, ácido ocadaico, estrés oxidativo, peróxido de hidrógeno, melatonina
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/68118
Especialidades
 Principal: Bioquímica,
Principal: Bioquímica,
 Relacionadas: Farmacología, Medicina Interna,
Relacionadas: Farmacología, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Pedro Montilla López. Departamento de Bioquímica y Biología Molecular, Facultad de Medicina, Universidad de Córdoba. Avenida Menéndez Pidal s/n, 14004-Córdoba, España Montilla López, Pedro
MELATONIN PREVENTS OXIDATIVE STRESS INDUCED BY OKADAIC ACID AND HYDROGEN PEROXIDE IN N1E-115 CELLS
 Abstract
Abstract
The present study with N1E-115 neuroblastoma cells evaluated the oxidative stress induced by okadaic acid, hydrogen peroxide and okadacia acid plus hydrogen peroxide, as well as the protective effect of melatonin. We demonstrated that exposure of cells to 50 nM acid and hydrogen peroxide (200 μM) for 2 h induced an intense oxidative stress characterized by a decrease of the GSH content and a reduction in cellular glutathione transferase and catalase activity. Likewise, these experimental conditions prompted an increase in lipid peroxidation products. The degree of oxidative stress induced by okadaic acid was almost duplicated in the presence of hydrogen peroxide. The effects induced by okadaic acid, hydrogen peroxide and okadaic acid plus hydrogen peroxide are prevented by melatonin (10-5 M). These data indicate the great importance of oxidative stress in the okadaic acid model, as well as its participation in the biochemical changes originated in the course and development of this experimental model, similar to Alzheimer's disease. These results seem to indicate the antioxidative and protective effect of melatonin.
 Key words
Key words
N1E-115 cells, Alzheimer's disease, okadaic acid, oxidative stress, hydrogen peroxide, melatonin
LA MELATONINA EVITA EL ESTRES OXIDATIVO INDUCIDO POR ACIDO OCADAICO Y PEROXIDO DE HIDROGENO EN CELULAS N1E-115
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
Es un hecho aceptado que las especies reactivas de oxígeno (ROS), además de participar en el envejecimiento, se involucran en la patogenia y evolución de procesos neoplásicos e inflamatorios así como en los ligados a radiaciones y agentes tóxicos de distinta naturaleza. Asimismo, son numerosos los estudios que relacionan las ROS con las enfermedades neurodegenerativas más frecuentes (Alzheimer, Parkinson, Huntington y esclerosis lateral amiotrófica).1-8 Por ejemplo, en la patogénesis y acción neurotóxica mediada por el péptido beta-amiloide (Aβ), presente en la enfermedad de Alzheimer, se invoca la concurrencia de dos principales cascadas moleculares: la mediada por Ca2+, activación de la óxido nítrico sintasa (NOS) y enzimas proteolíticas, cuyos mecanismos en conjunto conducen a la generación de cambios genéticos y muerte celular por apoptosis, y los procesos oxidativos generadores de productos finales de glucosilación avanzada (AGE), radicales libres (FR) y activación del factor nuclear κB (NFκB).9-11 Junto a estos procesos interesan en las enfermedades neurodegenerativas los mecanismos de fosforilación/desfosforilación en los que participan, entre otras, las proteínas fosfatasa tipo 1 (PP1) y tipo 2A (PP2A),12-13 proteínas que son inhibidas por ácido ocadaico (ácido okadaico).
El ácido ocadaico es un poliéter de ácidos grasos producido por dinoflagelados marinos y acumulado en el tracto digestivo de crustáceos y de la esponja negra (Halichondria okadaii), en la que fue aislado por vez primera.14-16 Se trata de un potente y específico inhibidor de PP1 y PP2A, las que desfosforilan residuos serina y treonina en células eucariotas.17-19 También promueve la aparición de tumores, lipoperoxidación y apoptosis en cultivos celulares, órganos y medios biológicos de ratón.20-24 De igual modo, produce alteraciones bioquímicas, fisiológicas y morfológicas compatibles con las encontradas en enfermedades neurodegenerativas25,17 y que se caracteriza por cambios en la organización del citoesqueleto, fosforilación de la proteína tau, estrés oxidativo y apoptosis.26-36 Datos de Pérez y col. tanto en cultivos de neuroblastoma SH-SY5Y como COS-1 ponen de manifiesto aumento de los niveles de 4-hidroxi-2-nonenales, cuya interacción con la proteína tau se relaciona con la formación de filamentos helicoidales apareados (PHF).37-39 Estas sugerencias han sido demostradas por Mattson y col. en cultivos de neuronas de hipocampo de rata tratadas con 4-hidroxinonenales.40 En este mismo modelo, He y col. constataron que la administración de ácido ocadaico determina cambios en la conducta y memoria espacial de ratas.41
Nuestro grupo realizó estudios in vitro e in vivo que apoyan la hipótesis de una participación del estrés oxidativo en la génesis y evolución del modelo experimental inducido por ácido ocadaico en células N1E-115.42,43Otros grupos de investigadores han puesto de manifiesto la regulación in vivo e in vitro de proteínas fosfatasa, tales como PP1, PP2A, fosfatasa tipo 2C (PP2C), calcineurina y tirosina fosfatasa por ROS. En efecto, el H2O2 desencadena la inhibición de vías de señalización intracelular que involucran calcineurina, PP1 y PP2A, mientras que la incorporación de ascorbato y superóxido dismutasa evita la inactivación de PP1 y calcineurina, respectivamente.44-49Sobre la base de lo anteriormente expuesto, el presente estudio tiene como objetivo principal valorar, comparativamente, el estrés oxidativo inducido tanto por el ácido ocadaico como por el H2O2 y ácido ocadaico + H2O2. También, explorar el efecto protector de la melatonina en las tres condiciones experimentales, tomando como marcadores para su valoración: el contenido en glutatión reducido, los niveles de lipoperoxidación y la actividad de glutatión transferasa, glutatión reductasa y catalasa.
Material y métodos
Materiales
El medio de cultivo, el suero de caballo y el suero bovino fueron provistos por Gibco BRL (Gaithersburg, MD, EE.UU.). El ácido ocadaico, el peróxido de hidrógeno, la melatonina y el resto de los productos químicos fueron obtenidos de Sigma Chemical Co. (St. Louis, MO, EE.UU.).
Cultivo celular
Las células de neuroblastoma N1E-115 fueron sembradas a una densidad de 200 000 células/mm2 en placas de Petri de 35 mm. Las células en medio Dulbecco's modified Eagle's (DMEM) complementado con 10% de suero bovino, 5% de suero de caballo, 100 UI/ml de penicilina y 100 mg/ml de estreptomicina fueron cultivadas durante 96 horas a 37ºC en atmósfera de CO2 al 5%.
Diseño experimental
Se prepararon neuroblastomas N1E-115 incubados durante 2 horas con: i) 50 nM de ácido ocadaico (AO) en dimetilsulfóxido (DMSO), que se incorporó al medio de cultivo; ii) 200 μM de peróxido de hidrógeno (HP), y iii) 10-5 M de melatonina (MEL) en DMSO. Todos los cultivos celulares fueron preincubados con melatonina o vehículo durante dos horas antes de añadir ácido ocadaico o peróxido de hidrógeno o ambos, manteniéndose hasta el final del estudio.
Productos de lipoperoxidación
El grado de lipoperoxidación se determinó en homogenados celulares, expresándose como malonildialdehído+4-hidroxialquenales nanomol/miligramo de proteína (MDA+4-HDA nmol/mg proteína). La determinación se realizó con equipo LPO 586 (Oxis Internacional Inc., Portland, OR, EE.UU.).
Contenido en glutatión reducido
La determinación de GSH se realizó en homogenados celulares. Los resultados son expresados en nanomoles/miligramo de proteína (nmol/mg proteína). La cuantificación se valoró con el sistema GSH-400 (Oxis Internacional Inc., Portland, OR, EE.UU.).
Actividad enzimática
La actividad de la glutatión transferasa (GSH-Tr, E.C. 2.5.1.18) y la glutatión reductasa (GSH-Rd, E.C. 1.6.4.2) fue valorada de acuerdo con el método descrito por Jaskot (1983).50 La actividad se expresa en unidades/miligramo de proteína (U/mg proteína).
La catalasa se analizó en la fracción citosólica de acuerdo con el procedimiento desarrollado por Aebi (1984).51 Sus resultados se expresan en unidades/miligramo de proteína (U/mg proteína).
Contenido en proteínas
El contenido en proteínas totales de los homogenados celulares se valoró mediante la técnica de Bradford,52 usando albúmina bovina como estándar.
Estudio estadístico
El análisis estadístico se realizé con el paquete estadístico SPSS 11.0 para Windows®. La distribución de los valores de las diferentes variables estudiadas no mostró significación para la prueba de normalidad de Shapiro-Wilk. Para revelar la significación estadística entre diferentes grupos de tratamiento se realizó un análisis de varianza de una vía (One-way ANOVA) seguido de la prueba post hoc de Bonferroni para comparaciones múltiples. Las diferencias fueron consideradas significativas con una p < 0.05. Todos los valores se expresan como la media ± error estándar.Tabla 1Resultados
Perfil basal
Los resultados muestran que la exposición de células N1E-115 al ácido ocadaico desencadena un estado oxidativo similar al desarrollado por la adición de peróxido de hidrógeno. En ambas situaciones experimentales se observa un aumento significativo en los niveles de lipoperoxidación (figura 1), depleción en el contenido de GSH (figura 2) y decremento de la actividad de las enzimas GSH-Tr, GSH-Rd y catalasa (tabla 1). Asimismo, se observa que los efectos del ácido ocadaico fueron potenciados por la presencia simultánea de peróxido de hidrógeno (figuras 1 y 2, y tabla 1, respectivamente).
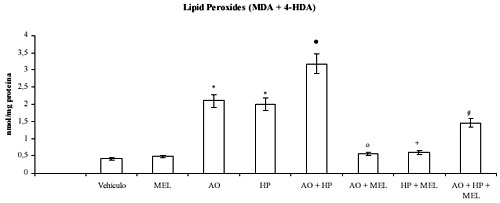
Figura 1. Efecto de la melatonina (MEL) sobre los cambios en los niveles de lipoperoxidación inducidos por ácido ocadaico (AO) en células N1E-115 incubadas con peróxido de hidrógeno (HP). Los resultados se expresan como la media ± SD de seis experimentos individuales expresados como nanomoles pro miligramo de proteína (nmol/mg proteína). * p < 0.001 versus control; • p < 0.001 versus ácido ocadaico; º p < 0.001 versus ácido ocadaico; + p < 0.001 versus peróxido de hidrógeno; # p < 0.001 versus ácido ocadaico + peróxido de hidrógeno.
Efecto de la incubación con melatonina
La incorporación de melatonina a los cultivos de neuroblastoma N1E-115 revirtió los efectos oxidativos producidos por el ácido ocadaico y el peróxido de hidrógeno tal como indica el significativo descenso de los niveles de malonildialdehído y 4-hidroxialquenales (figura 1), el mantenimiento en contenido de GSH (figura 2) y la normalización de las actividades de las enzimas analizadas (Tabla 1).
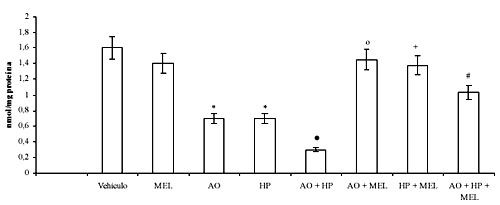
Figura 2. Efecto de la melatonina (MEL) sobre los cambios en los niveles de GSH inducidos por el ácido ocadaico (AO) en células N1E-115 incubadas con peróxido de hidrógeno (HP). Los resultados se expresan como la media ± SD de seis experimentos individuales expresados como nanomoles por miligramo de proteína (nmol/mg proteína). * p < 0.001 versus control; • p < 0.001 versus ácido ocadaico; º p < 0.001 versus ácido ocadaico; + p < 0.001 versus peróxido de hidrógeno; # p < 0.001 versus ácido ocadaico + peróxido de hidrógeno.
Discusión
En el presente estudio se observa cómo la adición al medio de cultivo de ácido ocadaico, H2O2 o de ambas a la vez en neuroblastomas N1E-115 determina incrementos en la lipoperoxidación, depleción en el contenido de GSH y descensos de las actividades enzimáticas estudiadas. Cuando estos cultivos son pretratados con melatonina todos los cambios son evitados, tanto en el caso del ácido ocadaico, como con H2O2 y con ácido ocadaico más H2O2.
Nuestro grupo ha puesto de manifiesto la participación in vitro del estrés oxidativo inducido por ácido ocadaico en cultivos de neuroblastoma N1E-11542 e in vivo por la adiministración de este ácido por vía intracerebroventricular.43 Paralelamente, en estos modelos se estudia el efecto protector de la melatonina, demostrándose que tales guardan relación en tiempo y dosis. Datos similares fueron aportados por Benítez-King y col. que demuestran además que el ácido ocadaico induce en este neuroblastoma colapso del citoplasma, alteración del citoesqueleto y apoptosis, cambios que son bloqueados por la presencia de melatonina.53
Por otra parte, diferentes oxidantes y antioxidantes se relacionan con el control de proteínas fosfatasa, como calcineurina y fosfatasa tipo 2C (PP2C). Asimismo, son abundantes los datos que refieren la influencia del H2O2 en la génesis del estrés oxidativo y en la regulación de señales y vías implicadas en la muerte celular programada [proteína quinasa 1 reguladora de señales de apoptosis (ASK1), NFκB, proteínas quinasa p53, proteínas de choque térmico (HSP) y cisteinil aspartato proteinasa (caspasa-3)].54,59 Fisiológicamente, los efectos nocivos del H2O2 son anulados por las enzimas catalasa (E.C.: 1.11.1.6) y glutatión peroxidasa (GSH-Px; E.C.: 1.11.1.9), cuyas actividades y expresiones génicas están reguladas por factores tales como estrés oxidativo, envejecimiento, inflamación, hormonas y presencia de antioxidantes.55
Rao y Clayton demostraron que el peróxido de hidrógeno (H2O2) inhibe la actividad de PP2A e incrementa la fosforilación de proteínas en células Caco-2 y que la actividad de PP2A es regulada por el estado redox del glutatión. Así, el glutatión oxidado (GSSG) inhibe la actividad de la enzima, mientras que el glutatión reducido (GSH) restaura la actividad de PP2A.56 Resultados que avalan la hipótesis de una estrecha relación entre el estrés oxidativo y el grado de fosforilación de proteínas asociadas a microtúbulos (MAP), como la proteína tau, lo que apoya de forma indirecta en nuestro modelo experimental la participación de un estrés oxidativo así como el mantenimiento del estado de fosforilación proteica inducido por el ácido ocadaico. Esta situación crea un círculo vicioso que se inicia con la inhibición de fosfatasas, continúa con el estrés oxidativo que parece pontenciar aun más el efecto del ácido ocadaico sobre el estado de fosforilación. La presencia de la melatonina, por su acción antioxidante, podría romper este círculo vicioso.
En resumen, nuestro estudio muestra y confirma dos fenómenos principales: i) la generación de un intenso estrés oxidativo inducido tanto por el ácido ocadaico como por H2O2 y ácido ocadaico + H2O2; y ii) el efecto protector de la melatonina. De lo que se extrae como hecho de interés, en el primer caso, el empleo de ácido ocadaico como herramienta útil para el estudio de mecanismos involucrados en las enfermedades neurodegenerativas y, respecto del segundo, por su acción antioxidante, la posible aplicación de la melatonina con fines terapéuticos.
Los autores no manifiestan conflictos
 Bibliografía del artículo
Bibliografía del artículo
- Barnham KJ, Masters CL, Bush AI. Neurodegenerative diseases and oxidative stress. Nat. Rev. Drug Discov. 2004; 3(3):205-214.
- Emerit J, Edeas M, Bricaire F. Neurodegenerative disease and oxidative stress. Biomed. Pharmacother. 2004; 58(1):39-46.
- Bossy-Wetzel E, Barsoum MJ, Godzik A y col. Mitochondrial fission in apoptosis, neurodegeneration and aging. Curr. Opin. Cell. Biol. 2003; 15(6):706-716.
- Rego AC, Oliveira CR. Mitochondrial dysfunction and reactive oxygen species in excitotoxicity and apoptosis: implications for the pathogenesis of neurodegenerative diseases. Neurochem. Res. 2003; 28(10):1563-1574.
- Uchida K. 4-Hydroxy-2-nonenal: a product and mediator of oxidative stress. Prog. Lipid Res. 2003; 42(4):318-343.
- Liu Q, Raina AK, Smith MA y col. Hydroxynonenal, toxic carbonyls, and Alzheimer disease. Mol. Aspects Med. 2003; 24(4-5):305-513.
- Eckert A, Keil U, Marques CA y col. Mitochondrial dysfunction, apoptotic cell death, and Alzheimer's disease. Biochem. Pharmacol. 2003; 66(8):1627-1634.
- Perry G, Taddeo MA, Nunomura A y col. Comparative biology and pathology of oxidative stress in Alzheimer and other neurodegenerative diseases: beyond damage and response. Comp. Biochem. Physiol. C Toxicol. Pharmacol. 2002; 133(4):507-513.
- Velez-Pardo C, Ospina GG, Jimenez del Rio M. Aβ[25-35] peptide and iron promote apoptosis in lymphocytes by an oxidative stress mechanism: involvement of H2O2, caspase-3, NF-κB, p53 and c-Jun. Neurotoxicology 2002; 23(3):351-365.
- Zhu X, Rottkamp CA, Coux H y col. Activation of p38 kinase links tau phosphorylation, oxidative stress, and cell cycle-related enventes in Alzheimer disease. Neuropathol. Exp. Neruol. 2000; 59(10):880-888.
- Harkany T, Hortobágyi T, Sasvári M y col. Neuroprotective approaches in experimental models of β-amyloid neurotoxicity: relevance to Alzheimer's disease. Prog. Neuropsychopharmacol. Biol. Psychiatry. 1999; 23(6):963-1008.
- Arias C, Sharma N, Davies P y col. Okadaic acid induces early changes in microtubule-associated protein 2 and tau phosphorylation prior to neurodegeneration in cultured cortical neurons. J. Neurochem. 1993; 61(2):673-682.
- Dupont-Wallois L, Sautiere PE, Cocquerelle C y col. Shift from fetal-type to Alzheimer-type phosphorylated tau proteins in SKNSH-SY 5Y cells treated with okadaic acid. FEBS Lett. 1995; 357(2):197-201.
- Takai A, Bialojan C, Troxchka M y col. Smooth muscle myosin phosphatase inhibition and force enhancement by black sponge toxin. FEBS Lett. 1987; 217(1):81-84.
- Bialojan C y Takai A. Inhibitory effect of a marine-sponge toxin, okadaic acid on protein phosphatases: specificity and kinetics. Biochem. J. 1988; 256(1):283-290.
- Dickey RW, Bobzin SC, Faulkner DJ y col. Identification of okadaic acid from a Caribbean dinoflagellate, Prorocentrum concavum. Toxicon. 1990; 28(4):371-377.
- Arendt T, Holzer M, Brucker MK y col. The use of okadaic acid in vivo and the induction of molecular changes typical for Alzheimer's disease. Neuroscience. 1998; 85(4):1337-1340.
- Boe R, Giertsen BT, Vintermyr OK y col. The protein phosphatase inhibitor okadaic acid induces morphological changes typical of apoptosis in mammalian cells. Exp. Cell Res. 1991; 195(1):237-246.
- Chiou JY y Westhead EW. Okadaic acid, a protein phosphatase inhibitor, inhibits nerve growth factor-directed neurite outgrowth in PC12 cells. J. Neurochem. 1992; 59(5):1963-1966.
- Fujita M, Goto K, Yoshida K y col. Okadaic acid stimulates expression of Fas receptor and Fas ligand by activation of nuclear factor κB in human oral squamous carcinoma cells. Oral Oncol. 2004; 40(2):199-206.
- Traore A, Ruiz S, Baudrimont I y col. Combined effects of okadaic acid and cadmium on lipid peroxidation and DNA bases modifications (m5dC and 8-(OH)-dG) in Caco-2 cells. Arch. Toxicol. 2000; 74(2):79-84.
- Traoré A, Bonini M, Dano SD y col. Synergistic effects of some metals contaminating mussels on hte cytotoxicity of the marine toxin okadaic acid. Arch. Toxicol. 1999; 73(6):289-295.
- Schonthal AH. Role of PP2A in intracellular signal transduction pathways. Front. Biosci. 1998; 3:D1262-D1273.
- Nago M, Shima H, Nakayasu M y col. Protein serine/threonine phosphatases as binding proteins for okadaic acid. Mutat. Res. 1995; 333(1-2):173-179.
- Iqbal K, Alonso AC, Gong CX y col. Mechanisms of neurofibrillary degeneration and the formation of neurofibrillary tangles. J. Neural. Transm. Suppl. 1998; 53:169-180.
- Boe R, Giertsen BT, Vintermyr OK y col. The protein phosphatase inhibitor okadaic acid induces morphological changes typical of apoptosis in mammalian cells. Exp. Cell Res. 1991; 195(1):237-246.
- Chiou JY y Westhead EW. Okadaic acid, a protein phosphatase inhibitor, inhibits nerve growth factor-directed neurite outgrowth in PC12 cells. J. Neurochem. 1992; 59(5):1963-1966.
- Okada D. Differential effects of protein kinase C on neuronal nitric oxide synthase activity in rat cerebellar slices and in vitro. J. Chem. Neuroanat. 1996; 10 (3-4):213-220.
- Garver TD, Lehman RA y Billingsley ML. Microtubule assembly competence analysis of freshly-biopsied human tau, dephosphorylated tau, and Alzheimer tau. J. Neurosci. Res. 1996; 44(1):12-20.
- Nelson PT y Saper CB. Injections of okadaic acid, but not beta-amyloid peptide, induce Alz-50 immunoreactive dystrophic neurites in the cerebral cortex of sheep. Neurosci. Lett. 1996; 208(2):77-80.
- Arias C, Becerra-García F, Arrieta I y col. The protein phosphatase inhibitor okadaic acid induces heat shock protein expression and neurodegeneration in rat hippocampus in vivo. Exp. Neurol. 1998; 153(2):242-254.
- Runden E, Seglen PO, Haug FM y col. Regional selective neuronal degeneration after protein phosphatase inhibition in hippocampal slice cultures: evidence for a MAP kinase-dependent mechanism. J. Neurosci. 1998;18(18):7296-7305.
- Shinohara S y Kawasaki K. Electrophysiological changes in rat hippocampal pyramidal neurons produced by cholecystokinin octapeptide. Neuroscience. 1997; 78(4):1005-1016.
- Tapia R, Pena F y Arias C. Neurotoxic and synaptic effects of okadaic acid, an inhibitor of protein phosphatases. Neurochem. Res. 1999; 24(11):1423-1430.
- Lee J, Hong H, Im J y col. The formation of PHF-1 and SMI-31 positive dystrophic neuritis in rat hippocampus following acute injection of okadaic acid. Neurosci. Lett. 2000; 282(1-2):49-42.
- Chen KD, Lai MT, Cho JH y col. Activation on p38 mitogen-activited protein kinase and mitochondrial Ca(2+)-mediated oxidative stress are essential for the enhanced expression of grp78 induced by the protein phosphatase inhibitors okadaic acid and calyculin A. J. Cell Biochem. 2000; 76(4):585-595.
- Chang WM, Chen KD, Chen LY y col. Mitochondrial calcium-mediated reactive oxygen species are essential for the rapid induction of the grp78 gene in 9L rat brain tumour cells. Cell Signal. 2003; 15(1):57-64.
- Pérez M, Hernández F, Gómez-Ramos A y col. Formation of aberrant phosphotau fibrillar polymers in neural cultured cells. Eur. J. Biochem. 2002; 269(5):1484-1489.
- Pérez M, Cuadros R, Smith MA y col. Phosphorylated, but not native, tau protein assembles following reaction with the lipid peroxidation product, 4-hydroxy-2-nonenal. FEBS Lett. 2000; 486(3):270-274.
- Medina M, García-Rocha M, Padilla R y col. Protein kinases involved in the phosphorylation of human tau protein in transfected COS-1 cells. Biochim. Biophys Acta. 1996; 1316(1):43-50.
- Mattson MP, Fu W, Waeg G y col. 4-Hydroxynonenal, a product of lipid peroxidation, inhibits dephosphorylation of the microtubule-associated protein tau. Neuroreport. 1997; 8(9-10):2275-2281.
- He J, Yamada K, Zou IB y col. Spatial memory deficit and neurodegeneration induced by the direct injection of okadaic acid into the hippocampus in rats. J. Neural Transm. 2001; 108(12):1435-1443.
- Montilla-López P, Muñoz-Agueda MC, Feijóo-López M y col. Comparison of melatonin versus vitamin C on oxidative stress and antioxidant enzyme activity in Alzheimer's disease induced by okadaic acid in neuroblastoma cells. Eur. J. Pharmacol. 2002; 451(3):237-243.
- Túnez I, Muñoz MC, Feijóo M y col. Protective melatonin effect on oxidative stress induced by okadaic acid into rat brain. J. Pineal Res. 2003; 34(4):265-268.
- Jones WK, Brown M, Ren X y col. NF-κB as an integrator of diverse signaling pathways: the heart of myocardial signaling Cardiovasc. Toxicol. 2003; 3(3):229-254.
- Ullrich V, Namgaladze D, Frein D. Superoxide as inhibitor of calcineurin and mediator of redox regulation. Toxicol. Lett. 2003;139(2-3):107-110.
- Calabrese V, Scapagnini G, Colombrita C y col. Redox regulation of heat shock protein expression in aging and neurodegenerative disorders associated with oxidative stress: A nutritional approach. Amino Acids. 2003; 25 (3-4):437-444.
- Goldbraum O, Richter-Landsberg Ch. Activation of PPA2-like phosphatase and modulation of tau phosphorylation accompany stress-induced apoptosis in cultured oligodendrocytes. Glia 2002; 40(3):271-282.
- Rusnak F, Reiter T. Sensing electrons: protein phosphatase redox regulation. Trends Biochem. Sci. 2000; 25(11):527-529.
- Krejsa CM, Schieven GL. Impact of oxidative stress on signal transduction control by phosphotyrosine phosphatases. Environ. Health Perspect. 1998; 106(Suppl 5):1179-1184.
- Jaskot RH, Charlet EG, Grose EC y col. An automated analysis of glutathione peroxidase, S-transferase, and reductase activity in animal tissue. J. Anal. Toxicol. 1983; 7(2):86-88.
- Aebi H. Catalase in vitro. Methods Enzymol. 1984; 105:121-126.
- Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Ann. Biochem. 1976; 72:248-254.
- Benítez-King G, Túnez I, Bellón A y col. Melatonin prevents cytoskeletal alterations and oxidtive stress induced by okadaic acid in N1E-115 cells. Exp. Neurol. 2003; 182(1):152-259.
- Goldman EH, Chen L, Fue H. Activation of apoptosis signal-regulating kinase 1 by reactive oxygen species through dephosphorylation at Ser967 and 14-3-3 dissociation. J. Biol. Chem. 2004; 279(11):10442-10449.
- Rodríguez C, Mayo JC, Sainz RM y col Regulation of antioxidant enzymes: a significant role for melatonin. J. Pienal Res. 2004; 36(1):1-9.
- Rao RK, Clayton LW. Regulation of protein phosphatase 2A by hydrogen peroxide and glutathionylation. Biochem. Biophys. Res Commun. 2002; 293(1):610-616.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|





