|
Coautores
Misleidis Sardiñas Aragón* Grechen García León* María Rosarys Martínez Romero** Raúl Díaz Rodríguez***
Licenciada, Instituto de Medicina Tropical Pedro Kourí*
Médica Microbióloga, Instituto de Medicina Tropical Pedro Kourí**
Licenciado en Bioquímica,Doctor en Ciencias, Instituto de Medicina Tropical Pedro Kourí***
|
|
Recepción del artículo: 0 de , 0000
|
|
Aprobación: 0 de , 0000
|
 Conclusión breve
Conclusión breve
El aumento de las infecciones por micobacterias ambientales u oportunistas coincide mundialmente con el declive de la infección tuberculosa e incremento de la infección por el virus de inmunodeficiencia humana VIH. El objetivo de nuestro estudio fue conocer la variabilidad de especies aisladas para establecer un referente actualizado sobre las infecciones causadas por estas.
 Resumen
Resumen
El aumento de las infecciones por micobacterias ambientales u oportunistas (MAO) coincide mundialmente con el declive de la infección tuberculosa e incremento de la infección por el virus de inmunodeficiencia humana (VIH). El presente trabajo es un estudio retrospectivo realizado en el Laboratorio Nacional de Referencia-Investigaciones de Tuberculosis/Micobacterias/Lepra (LNRI-TB/Lepra/Micobacterias), del Instituto de Medicina Tropical Pedro Kourí (IPK), La Habana, Cuba, durante el período enero 2014-diciembre 2018. El objetivo de nuestro estudio fue conocer la variabilidad de especies aisladas para establecer un referente actualizado sobre las infecciones causadas por estas. En este trabajo se clasificaron-identificaron 413 cepas procedentes de pacientes sintomáticos; 162 (39.22%) eran aislamientos de pacientes con VIH/sida atendidos en nuestro Hospital Nacional de Referencia a Atención al paciente VIH/sida (IPK), y el resto (n = 251 [60.77%]), procedentes de pacientes inmunocompetentes, incluyendo aislamientos recibidos de los Centros Provinciales de Higiene, Epidemiología, y Microbiología (CPHEM). Las muestras fueron analizadas con las técnicas convencionales establecidas: las pulmonares fueron descontaminadas por el método de Petroff modificado; las extrapulmonares, por el método del ácido sulfúrico al 4%; el cultivo se realizó en medio de Löwenstein-Jensen modificado. Posteriormente se realizó la clasificación-identificación de especies según el esquema fenotípico-bioquímico establecido. Las especies con mayor porcentaje de aislamiento pertenecieron a los Grupos III y IV, complejo Mycobacterium avium-intracellulare (34.14%) y complejo M. fortuitum (20.82%), respectivamente. Estos resultados permitirán conocer la prevalencia de estas especies en nuestro país, reafirmando la importancia diagnóstica de estos microorganismos para aplicar tratamiento específico, sobre todo en pacientes con factores de riesgo, en quienes es más probable la diseminación de la infección.
 Palabras clave
Palabras clave
VIH/Sida, complejo mycobacterium avium-intracellulare , complejo mycobacterium fortuitum
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/163037
Especialidades
 Principal: Diagnóstico por Laboratorio, Infectología,
Principal: Diagnóstico por Laboratorio, Infectología,
 Relacionadas: Cirugía, Cuidados Intensivos, Dermatología, Epidemiología, Nefrología y Medio Interno, Neumonología,
Relacionadas: Cirugía, Cuidados Intensivos, Dermatología, Epidemiología, Nefrología y Medio Interno, Neumonología,
 Enviar correspondencia a:
Enviar correspondencia a:
Lilian María Mederos Cuervo, 11400, La Habana, Cuba
Identification of environmental or opportunistic mycobacterial species in symptomatic and HIV/AIDS patients
 Abstract
Abstract
The increase in infections by environmental or opportunistic mycobacteria (MAO) coincides worldwide with the decline in tuberculosis infection and an increase in infection by the human immunodeficiency virus (HIV). The present work is a retrospective study carried out at the National Reference Laboratory-Tuberculosis/Mycobacterial/Leprosy Research (LNRI-TB / Leprosy / Mycobacteria), of the Pedro Kourí Institute of Tropical Medicine (IPK), La Habana, Cuba, during the period January 2014-December 2018. The objective of our study was to know the variability of isolated species to establish an updated reference on the infections caused by MAO. In this study, 413 strains from symptomatic patients were classified and identified; 162 (39.22%) were isolates from patients with HIV/AIDS treated at our National Hospital of Reference for Attention to HIV/AIDS patients (IPK), and the remaining (n=251 [60.77%]), from immunocompetent patients, including isolates received from the Provincial Centers of Hygiene, Epidemiology, and Microbiology (CPHEM). The samples were analyzed with the established conventional techniques: the lung samples were decontaminated by the modified Petroff method; the extrapulmonary, by the 4% sulfuric acid method; the culture was carried out in modified Löwenstein-Jensen medium. Subsequently, the classification-identification of species was carried out according to the established phenotypic-biochemical scheme. The species with the highest percentage of isolation belonged to Groups III and IV, Mycobacterium avium-intracellulare complex (34.14%), and M. fortuitum complex (20.82%), respectively. These results will allow us to know the prevalence of these species in our country, emphasizing the diagnostic importance of these microorganisms and thus apply a specific treatment, especially in patients with risk factors, in whom the spread of the infection is more likely.
 Key words
Key words
HIV /Aids
IDENTIFICACIÓN DE ESPECIES MICOBACTERIANAS AMBIENTALES U OPORTUNISTAS EN PACIENTES SINTOMÁTICOS Y CON VIH/SIDA
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
El género Mycobacterium actualmente presenta más de 150 especies. El grupo de especies micobacterianas diferentes del complejo Mycobacterium tuberculosis (MTBC) y de M. leprae son denominadas de diferentes formas, las más utilizadas han sido; micobacterias atípicas (MA), no tuberculosas (MNT) y ambientales u oportunistas (MAO). Estas micobacterias son microorganismos ampliamente distribuidos en el medio ambiente, agua (corriente o no), tierra, polvo, leche, diferentes especies de animales, e incluso instrumental y soluciones de uso médico o de laboratorio, incluso en algunos casos pueden formar parte de la flora saprófita del hombre o actuar como verdaderos patógenos. Se plantea que la infección puede tener lugar tras la inhalación, inoculación o ingestión del material contaminado, la transmisión entre personas no ha sido comprobada.1-3 Estas especies difieren del bacilo tuberculoso en cuanto a velocidad de crecimiento, capacidad de producir pigmentos, requerimientos nutricionales, actividad enzimática, sensibilidad a la temperatura y resistencia a los agentes antituberculosos.4
La relación de las MAO con enfermedades en el ser humano es ocasional u oportunista; no todas las especies han sido reconocidas como patógenas, la capacidad de producir enfermedad depende no solo de los factores de patogenicidad intrínsecos, sino sobre todo de factores del huésped, tales como la integridad de su sistema inmune. Dentro del amplio grupo de posibles síndromes denominados micobacteriosis, estos habitualmente han estado asociados con algún tipo de inmunosupresión, como pacientes con VIH/sida, oncohematológicos, receptores de trasplantes y tratados con fármacos biológicos antifactor de necrosis tumoral alfa (TNF-a).1,5,6 Entre las infecciones más comunes, en primer lugar está la respiratoria, con frecuencia relacionada con algún tipo de patología pulmonar crónica (fibrosis quística, enfermedad pulmonar obstructiva crónca [EPOC], bronquiectasias y otras); le siguen las infecciones en partes blandas, piel, renales y otras menos frecuentes como las posquirúrgicas, así como linfadenitis. La identificación de estas especies puede realizarse mediante diferentes técnicas.6-10
El temprano y correcto diagnóstico microbiológico de estas especies permite lograr un mejor régimen terapéutico, evitando en estos pacientes la posibilidad de diseminación de la infección. Por todo lo anterior se recomienda mantener la vigilancia diagnóstica en este tipo de infecciones, tanto pulmonares como extrapulmonares, en especial en pacientes con algún tipo de inmunosupresión en donde la diseminación de la infección puede tener consecuencias fatales.
El objetivo de este trabajo fue resaltar la importancia diagnóstica de estas especies y establecer un referente actualizado sobre las infecciones causadas por MAO, con vistas a conocer la prevalencia de estas especies en nuestro país, mediante la clasificación-identificación de las MAO recibidas durante el período enero 2014-diciembre 2018.
Materiales y métodos
El presente trabajo es un estudio retrospectivo realizado en el período comprendido entre enero de 2014 y diciembre de 2018, en el Laboratorio Nacional de Referencia e Investigaciones de Tuberculosis/Micobacterias/Lepra (LNRI-TB/Lepra/Micobacterias), del Instituto de Medicina Tropical Pedro Kourí (IPK), La Habana, Cuba.
Durante este período se aislaron, clasificaron e identificaron 413 cepas procedentes de individuos sintomáticos. De estas, 162 (39.22%) corresponden aislamientos de pacientes infectados por el virus de la inmunodeficiencia humana (VIH) atendidos en el Hospital Nacional de Referencia de Atención al Paciente VIH/Sida-IPK, y el resto, 251 (60.77%) procedentes de sujetos inmunocompetentes, incluyendo los aislamientos recibidos de los Centros Provinciales de Higiene, Epidemiología, y Microbiología (CPHEM) de las diferentes provincias del país. Debemos aclarar que estos aislamientos fueron seleccionados según criterios establecidos por la American Thoracic Society. Las muestras fueron analizadas por las técnicas diagnósticas baciloscopia y cultivo. Para el procesamiento de muestras pulmonares se utilizó el método de Petroff modificado, en las extrapulmonares no estériles se utilizó el método del ácido sulfúrico al 4%, posteriormente estas fueron cultivadas en medio de Löwenstein-Jensen modificado e incubadas a 37°C. Las lecturas se realizaron semanalmente y ante la aparición de colonias se realizó tinción de Zielh-Neelsen a partir del cultivo para verificar la presencia de bacilos ácido-alcohol resistentes (BAAR). Con posterioridad al aislamiento micobacteriano se realizó la clasificación e identificación según el esquema establecido: test inmunocromatográfico TB Ag MPT64 para descartar Mycobacterium tuberculosis complex; a las cepas confirmadas como MNT se les realizó la caracterización fenotípica-bioquímica, producción de pigmentos, tiempo de crecimiento, crecimiento en presencia de diferentes sustratos y determinación de algunas enzimas como nitratasa, catalasa 68°C, catalasa vertical, ureasa, arilsulfatasa, lipasa, niacina, telurito de potasio, tolerancia al cloruro de sodio 5%, y toma de hierro.11,12
Resultados y discusión
En la Figura 1 se observa el total de aislamientos analizados por año, señalando los procedentes de pacientes con VIH/sida.
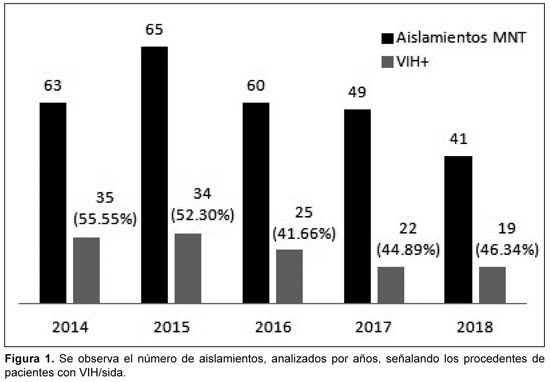
Respecto de los resultados expuestos en la Figura 1, se puede observar una discreta disminución del número de aislamientos obtenidos, esto podría explicarse debido a que en los últimos años nuestro país ha incrementado significativamente el uso de la terapia antirretroviral (TARV) en los pacientes con VIH/sida, con lo que se ha logrado que la incidencia de afección por el género Mycobacterium en este tipo de pacientes sea relativamente baja, al compararla con la informada por otras naciones; estos resultados son atribuibles a la eficacia de nuestro Programa Nacional de Control de Tuberculosis y Programa Nacional de Atención al paciente VIH/sida.14,15 Es sabido que la TARV, aunque no puede erradicar la infección por el VIH, inhibe la replicación viral por un considerable período de tiempo, además restaura y preserva el estado inmunológico al incrementar el número de linfocitos CD4, logrando con ello la disminución de la morbimortalidad, tanto la relacionada con el VIH, como con la de otro tipo de infecciones oportunistas, agudas o crónicas, con manifestaciones localizadas o sistémicas (entre estas las producidas por el género Mycobacterium), todo esto conlleva a mejorar la calidad y esperanza de vida de estos pacientes.13-15
La literatura describe el aumento de casos clínicos producidos por MNT en seres humanos, este hecho demuestra la importancia que tiene reconocer clínicamente la significación patogénica de muchas de las especies micobacterianas no tuberculosas, tanto en enfermedades pulmonares como extrapulmonares.16 En estudios realizados recientemente se incluyó el análisis de todas las especies micobacterianas aisladas en Asturias (España) durante el período 2005-2012, se obtuvo como resultado que los aislamientos se incrementaron en un 35%, frente a una disminución del 21% de los casos de MTB, y que las especies con mayor porcentaje de aislamiento fueron M. avium complex (MAC) y M. kansasii.17 En otro estudio se plantea que las diferentes especies de MNT presentan variaciones en su distribución geográfica en función de su capacidad para sobrevivir en las diferentes condiciones ambientales y también en relación con las posibilidades de aislamiento e identificación de los laboratorios locales, estas variaciones geográficas en la distribución se reflejan también en las diferentes patologías causadas por ellas en los seres humanos. En ese mismo estudio el autor hace referencia a otro trabajo realizado en Europa, en el que intervinieron 14 países con el objetivo de conocer la incidencia de estas infecciones. En el período establecido para el trabajo se notificaron en total 36 099 pacientes con aislamiento de MNT; las especies aisladas con mayor frecuencia fueron Mycobacterium avium complex, M. gordonae, M. xenopi, M. kansasii y M. fortuitum. Diversos países continúan investigando la frecuencia de aislamientos de estas especies, demostrando que hay un incremento significativo de las infecciones provocadas por ellas.18 En los Estados Unidos se demostró que el número de muertes por enfermedad asociadas a MAO se incrementó sobre todo en los pacientes con mayor riesgo. Entre los factores de riesgo encontrados relacionados con estas infecciones fueron: EPOC, neumoconiosis, bronquiectasias, tuberculosis previa, fibrosis posradioterapia, aspiración pulmonar crónica (enfermedad esofágica), fibrosis quística, alteraciones del sistema inmune, infección por VIH, alcoholismo, presencia de neoplasias (pulmonares o extrapulmonares) o diabetes mellitus.19 Sin embargo, hay que destacar que en un elevado porcentaje de pacientes que han tenido o tienen este tipo de infección, no se identifican factores de riesgo, es decir que son considerados pacientes inmunocompetentes.20,21
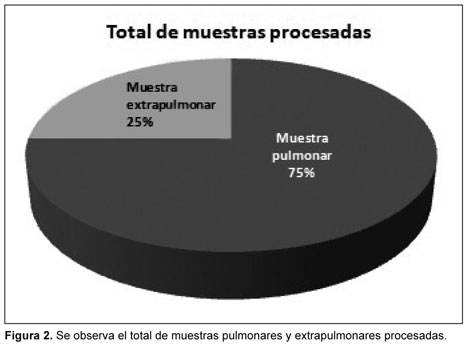
En la Figura 2 se observa el total de muestras pulmonares y extrapulmonares procesadas, según tipo de muestra, estos reafirman que prevalece el predominio de la muestra pulmonar por encima de la extrapulmonar. Al igual que en la TB, se describe que aproximadamente el 15% de los casos de infecciones por MAO pueden presentar afección extrapulmonar, la cual es mayormente producida por la diseminación hematógena y linfática del bacilo hacia otros órganos, la localización más frecuente también es la ganglionar. La sospecha de linfadenitis existe cuando el paciente (ya sea niño o adulto) presenta escrófulas o adenopatías subagudas o crónicas; más comúnmente en la región cervical-submaxilar, aunque en algunos casos también pueden ser intratorácicas e intraabdominales (mesentéricas o paraaórticas), o aparecer en la zona axilar, inguinal e intramamaria. Inicialmente son de consistencia dura, no fluctuantes, dolorosas o eritematosas, pero pueden supurar, drenar y necrosarse.22-24
Las infecciones extrapulmonares de piel y tejidos blandos suelen deberse a la inoculación directa a través de inyecciones y heridas traumáticas o quirúrgicas. No obstante, también pueden producirse en el contexto de una enfermedad diseminada por MAO, especialmente en pacientes inmunosuprimidos. Existen diversos factores de riesgo, entre los que se encuentra el compromiso inmunológico (secundario a infecciones, a patologías no infecciosas y a quimioterapia) o en pacientes con uso crónico de corticoides, cirugías contaminadas, traumatismo de mama, uso de implantes mamarios, tatuajes, piercing, acupuntura, liposucciones, lipotransferencias, lactancia, exposición laboral a limpieza de piscinas y jacuzzis.24,25
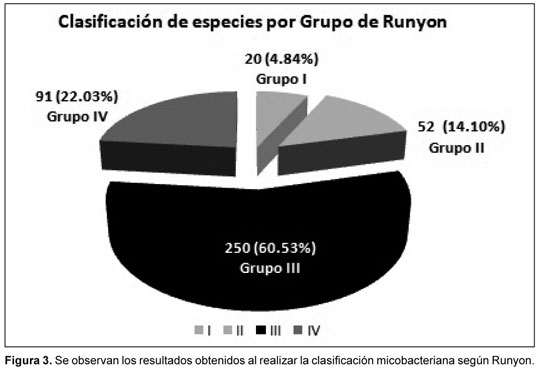
En la Figura 3 se muestran los resultados obtenidos tras realizar la clasificación por grupos según Runyon (1959), basándonos en el tiempo de crecimiento y la presencia o ausencia de pigmento; analizando estos resultados se puede apreciar que las especies micobacterianas con mayor porcentaje de aislamiento fueron las pertenecientes al Grupo III y al Grupo IV, o sea las especies denominadas “no cromógenas” y de “crecimiento rápido”, respectivamente.
Al analizar y comparar los resultados presentados en la Figura 3, con los descritos anteriormente por Valdivia y Ferrá, podemos afirmar que se mantienen como las especies micobacterianas predominantes las pertenecientes a los Grupos III y IV según la clasificación micobacteriana realizada por Runyon, incluso en la región oriental del país.26-30 Al analizar resultados más recientes, obtenidos en el LNRI-TB/Lepra/Micobacterias, donde también fueron incluidas muestras procedentes de pacientes con VIH/sida, se demostró que las especies con mayor porcentaje de aislamiento eran pertenecientes a los Grupos III y IV; entre estas, las más representativas fueron de crecimiento lento Mycobacterium avium-intracellulare complejo, M. malmoense, M. scrofulaceum, M. flavescens de crecimiento rápido, M. fortuitum, y M. chelonae.31-34 Finalmente, la Figura 4 refleja los resultados obtenidos en este trabajo según las especies identificadas.
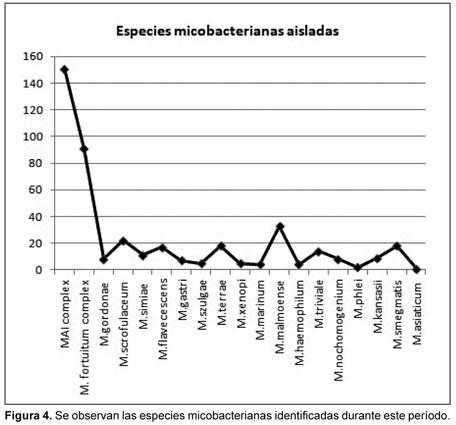
Observando estos podemos afirmar que las de mayor porcentaje de aislamiento fueron las pertenecientes al complejo M. avium-intracellulare [n = 151 (36.56%)] y las pertenecientes al complejo M. fortuitum [n = 91 (22.03%)], pertenecientes a los Grupos III y IV, respectivamente; seguidas por M. malmoense [n = 43 (10.40%)], M. scrofulaceum [n = 22 (5.32%)], M. terrae y M. smegmatis [ambos n = 18 (4.35%)], M. flavescens [n = 27 (6.53%)], M. triviale [n = 14 (3.38%)], M. simiae [n = 11 (2.66%)], M. kansasii [n = 9 (2.17%)], M. gordonae y M. nonchormogenicum [ambos n = 8 (1.93%)], M. gastri [n = 7 (1.70%)], M. szulgae y M. xenopi [ambos n = 5 (1.21%)], M. marinum y M. haemophilum [ambos n = 4 (1.0%)], M. phlei [n = 2 (0.50%)], y M. asiaticum [n = 1 (0.24%)]. Los resultados obtenidos en este trabajo siguen acordes a los descritos en la literatura.
Actualmente, en los laboratorios de Micobacteriología se recomienda la implementación de técnicas diagnósticas moleculares; sin embargo, estudios revisados recientemente reafirman que los métodos fenotípicos-bioquímicos no han perdido su vigencia y siguen siendo una importante herramienta diagnóstica para la identificación micobacteriana, a pesar de que la obtención de los resultados demore más, pues a través de ellos podemos observar características que no son detectables por las pruebas moleculares.35,36
Las especies micobacterianas no tuberculosas han cobrado protagonismo en los últimos años, en la actualidad representan aproximadamente el 30% al 40% del total de aislamientos en los laboratorios de Microbiología, lo que reafirma el aumento de la incidencia de infecciones producidas por estas especies. En general, en la literatura los datos acerca de la incidencia y prevalencia de MNT son escasos, pues estas no son de declaración obligatoria como sí es el caso de M. tuberculosis. A pesar de esta limitación es evidente que en las últimas décadas ha habido un incremento en las infecciones causadas por MNT en la mayoría de los países, aunque en general las tasas informadas de infección y enfermedad están subestimadas. Es importante valorar el significado de los aislamientos, siempre analizando el contexto clínico en el que tiene lugar cada uno de ellos, de acuerdo con las recomendaciones de las sociedades científicas reconocidas internacionalmente: American Thoracic Society (ATS), British Thoracic Society (BTS) y Sociedad Española de Neumología y Cirugía Torácica (SEPAR).37
En un estudio realizado en pacientes hospitalizados con infección por el VIH/sida y sin ella, se demostró que las infecciones provocadas por el género Mycobacterium, usualmente presentan compromiso pulmonar, aunque también está la afección extrapulmonar, con dependencia del deterioro que tenga el paciente en su barrera inmunológica la infección puede diseminarse. Si bien M. tuberculosis sigue siendo el agente etiológico predominante, los resultados de este trabajo demuestran que en un 17.3% de los casos tuvieron infección por MNT, incluso se han informado casos de coinfección entre ambas.38-40
Finalmente, los resultados obtenidos en este estudio demuestran que se debe ser más agresivo en la búsqueda de este tipo de infección, tanto pulmonar como extrapulmonar, en pacientes inmunocompetentes o inmunodeficientes, para que el enfermo pueda comenzar tempranamente una adecuada terapia, poder controlar la infección, y así prevenir las peligrosas formas de diseminación que generalmente tienen graves consecuencias, sobre todo en el grupo poblacional de alto riesgo, en particular en aquellos sujetos con VIH/sida. Además, estos resultados establecen un referente nacional actualizado, el cual puede orientar a la toma de decisiones clínicas basadas en recomendaciones sustentadas respecto de las especies micobacterianas no tuberculosas.
 Bibliografía del artículo
Bibliografía del artículo
1. Gould E, Rosenfeld EA. Mycobacterium species non tuberculosis. En: Long SS, Pickering LK, Prober CG. Principles and practice of pediatric infectious diseases. 2nd ed. New York: Churchill Livingstone, Inc, pp. 811-15, 2003.
2. Griffith DE, Aksamit T, Brown-Elliot BA, Catanzaro A, Daley C, Gordin F, et al. An official ATS/IDSA statement: Diagnosis, treatment, and prevention of Nontuberculous mycobacterial diseases. Am J Respir Crit Care Med 175:367-416, 2007.
3. Hoefsloot W, Van Ingen J, Andrejak C, Angeby K, Bauriaud R, Bemer P. The geographic diversity of nontuberculous mycobacteria isolated from pulmonary samples. Eur respir J 42:1604-132, 2013.
4. Tortoli E. Microbiological features and clinical relevance of new species of the genus Mycobacterium. Clin Microbiol Rev 27(4):727, 2014. DOI: 10.1128/CMR13.00035-14.
5. "Why me, why now?" Using clinical immunology and epidemiology to explain who gets nontuberculous mycobacterial infection. BMC Med 14:54, 2016. http://dx.doi.org/10.1186/s12916-016-0606-6.
6. Montúfar-Andrade FE, Villa-Franco JP, Montúfar-Pantoja MC, Cadavi-Usuga JC, Monsalve MA, Zuluaga M, Díaz L, Vega J, Vélez JD, Zuleta-Tobón JJ, Madrid C. Compromiso pulmonar en pacientes hospitalizados con infección por el virus de inmunodeficiencia humana en el Hospital Pablo Tobón Uribe (Medellín, Colombia). Infectio 20(4):211-17, 2016.
7. Moreno M, Quintana ME, Carrasco L, Pérez E, Delgado I. Mycobacterium lentiflavum en pacientes con fibrosis quística: ¿colonizante o patogénico? Archivos de Bronconeumología 54(12): 599-642, 2018.
8. López B, Beltrán A, Pitarch F, López I. Infección de prótesis total de rodilla por Mycobacterium fortuitum. Cartas científicas / Enferm Infecc Microbiol Clin 34(6):390-96, 2016.
9. Chand M, Lamagni T, Kranzer K, Hedge J, Moore G, Parks S, Collins S y cols. Insidious risk of severe Mycobacterium chimaera infection in cardiac surgery patients. Clinical Infectious Diseases 64(3):335-42, 2017.
10. Mederos LM, Jean-Louis F, Perovani MA, Montoro EH. Identificación de micobacterias no tuberculosas en pacientes VIH/SIDA por métodos convencionales y de fracciones de ácidos micólicos. Rev Soc Venezolana de Microbiología 27:50-53, 2007.
11. Barrera L. Manual para el diagnóstico bacteriológico de la tuberculosis. Normas y guía teórica. Parte II. Cultivo. INEI, ANLIS Dr. Carlos Malbrán. Argentina. Organización Panamericana de la Salud. Oficina Regional de la Organización Mundial de la Salud, 2008.
12. Organización Panamericana de la Salud (OPS). Manual para el diagnóstico bacteriológico de la tuberculosis. Normas y Guía técnica. Parte 2 Cultivo. Washington DC: OPS; 2008.
13. Nachega JB, Uthman OA, Mills EJ, Quinn TC. Adherence to antiretroviral therapy for the success of emerging interventions to prevent HIV transmission: A Wake up Call. J AIDS Clinic Res S4:007, 2012. doi:10.4172/2155-6113.S4-007.
14. Berenguer J. Mortalidad en personas infectadas por el virus de la inmunodeficiencia humana. Enferm Infecc Microbiol Clin 34(4):217-218, 2016.
15. Peralta Gómez I, Cabrera Rodríguez MC, Gutiérrez Díaz MJ. Coinfección TB/VIH: una amenaza para los programas de control de ambas enfermedades. Medicent Electrón 19(3):160-62, 2015.
16. Altet Gómez N. Micobacterias no tuberculosas: ¿una infección emergente? An Pediatr (Barc) 71(3):185-188, 2009.
17. Martínez González S, Cano Cortés A, Sota Yoldi LA, García García JM, Alba Álvarez LM, Palacios Gutiérrez JJ. Micobacterias no tuberculosas. ¿Una amenaza emergente? Arch Bronconeumol 53(10):554-60, 2017.
18. Martin Casabona N, Bahrmand AR, Bennesn J. Nontuberculous micobacterias: patters of isolation. A multicountry retrospective survey. Int J Tuberc Lung Dis 8:1186-93, 2004.
19. Montúfar FE, Madrid CA, Montúfar MC, Aguilar C, Saldarriaga C, Mesa MA, Quiroga A, Builes CE, Zuleta JJ, Molina OL. Caracterización de pacientes hospitalizados con infecciones causadas por micobacterias no tuberculosas, en un hospital de alta complejidad en Colombia. Infectio 18(4):135-42, 2014.
20. Henkle E, Hedberg K, Schafer S, Novosad S, Winthrop KL. Population-based incidence of pulmonary nontuberculous mycobacterial disease in Oregon 2007 to 2012. Annals ATS 12:642, 2015.
21. Mederos LM, Rodríguez F, Pomier O, Reyes A, Sardiñas M, García G, Martínez MR. Micobacteriosis en el tracto orofaríngeo en un paciente inmunocompetente. Salud(i)Ciencia 22:57-60, 2016.
22. Mederos LM, Sardiñas M, García G, Martínez MR, Reyes A, Díaz R. Frecuencia de aislamiento del género Mycobacterium en muestras de orina. Rev Chilena Infectol 32(5):591-592, 2015.
23. Mederos Cuervo LM, Sardiñas Aragón M, García León G, Guerra Rodríguez JC, Martínez Romero MR, Díaz Rodriguez R. Aspectos clínicos y aislamientos de micobacterias ambientales en muestras pulmonares y extrapulmonares. SIIC 21(1):35-39, 2014.
24. Magaña Leal JA, Bustos Saldaña R, Torres Baranda R, Cárdenas Cuevas AL, Quiñonez Cibrián E, Serrano Gómez MV. Micobacterias atípicas de secreción mamaria identificadas en el primer nivel de atención. Reporte de seis casos. Aten Fam 24(1):41-46, 2017.
25. Schcolnik CA, Hernández CA, Vega MM, Arenas GR, Fernández MR. Lipotransferencia complicada con micobacteriosis atípicas. Reporte de dos casos y revisión de la literatura. Gaceta Médica de México 150(Suppl3):311-6, 2014.
26. Valdivia JA, Ferrá C, Olivares E, Gutiérrez AM. Micobacterias no tuberculosas en pacientes sintomáticos de Ciudad de La Habana. Rev Cub Med Trop 37:231-7, 1985.
27. Ferrá C, Montoro E, Gutiérrez AM, Valdivia JA, Jiménez CA. Estudio de micobacterias no tuberculosas aisladas en Cuba en el período 1985-1989. Rev Cub Med Trop 44:205-7, 1992.
28. Mederos LM, Fofana S, Perovani MA, Sardiñas M, Motoro EH. Identificación de especies micobacterianas en Cuba. Archivos Venezolanos de Farmacología y Terapéutica 2:142-145, 2007.
29. Pérez ML. Comportamiento de la micobacteriosis atípica no tuberculosa en Moa. Monografias.com>Salud>Enfermedades. https://www.monografias.com/trabajos89/comportamiento-micobacteriosis-atipica/comportamiento-micobacteriosis-atipica.shtml. Consultado 21/3/2019.
30. Pila R, Vidal L, Pila R, Holguín VA. Micobacterias no tuberculosas en Camagüey. Archivo Médico de Camagüey 11(4):1025-0255, 2007.
31. Mederos LM, Perovani MA, Sardiñas M, García G, Echemendía M, Martínez R, Montoro EH. Diagnóstico de Mycobacterium tuberculosis en pacientes sintomáticos incluyendo los infectados con el síndrome de inmunodeficiencia adquirida (SIDA). Archivos Venezolanos de Farmacología y Terapéutica 27(2):121-123.30, 2008.
32. Mederos LM, Fleites G, Capó V, De Armas Y, Acosta MA, Martínez MR, Montoro EH. Linfadenitis por Mycobacterium incluyendo pacientes infectados por el Virus de Inmunodeficiencia Humana. Arch Ven Farm y Terap 30:54-57, 2011.
33. Castillo A, Díaz M, Mederos LM, Pérez A, Pomier O, Marshall AV, Castillo WJ. Infección pulmonar por micobacterias ambientales en pacientes VIH/SIDA atendidos en el Instituto de Medicina Tropical Pedro Kourí, enero 2006. Rev Panam Infectol 15:1-4, 2013.
34. Mederos Cuervo LM, Fleites G, Acosta MA, Romero JM, Valdés L, León R, Martínez MR, Díaz R. Micobacteriosis peritoneal por Mycobacterium avium-intracellulare en paciente con el síndrome de inmunodeficiencia adquirida. Salud(i)Ciencia 22:352-356, 2017.
35. Bhalla GS, Sarao MS, Kalra D, Bandyopadhyay K, John AR. Methods of phenotypic identification of non-tuberculous mycobacteria. Practical Laboratory Medicine. https://doi.org/10.1016/j.plabm.2018.e00107.
36. Tortone CA, Zumárraga MJ, Gioffr AK, Oriani DS. Utilization of molecular and conventional methods for the identification of nontuberculous mycobacteria isolated from different water sources. International Journal of Mycobacteriology 7(1):53-60, 2018.
37. Cardona PJ. Patogénesis de la tuberculosis y otras micobacteriosis. Enfermedades Infecciosas y Microbiología Clínica 36(1), 2017. DOI: 10.1016/j.eimc.2017.10.015.
38. Martínez-Moragón E, Menéndez R, Palasí P, Santos M, López-Aldeguer J. Enfermedades por micobacterias ambientales en pacientes con y sin infección por el VIH: características epidemiológicas, clínicas y curso evolutivo. Arch Bronconeumol 37:281-85, 2001.
39. Mederos Cuervo LM, Fleites G, Acosta MA, Romero JM, Valdés L, León R, Martínez MR, Díaz R. Micobacteriosis peritoneal por Mycobacterium avium-intracellulare en paciente con el síndrome de inmunodeficiencia adquirida. Salud(i)Ciencia 22:352-356, 2017.
40. Mederos LM, Reyes A, Rodríguez P, Váldez L, Sardiñas M, Martínez MR, Díaz R. Coinfección por Mycobacterium malmoense y Mycobacterium tuberculosis en paciente con el síndrome de inmunodeficiencia humana. Rev Peru Med Exp Salud Pública 31(4):788-92, 2015.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



