|
Coautores
Harry Pachajoa* Yoseth Ariza Araujo*
Médico, Universidad ICESI, Cali, Colombia*
|
|
Recepción del artículo: 29 de junio, 2018
|
|
Aprobación: 18 de septiembre, 2018
|
 Conclusión breve
Conclusión breve
Los datos de este estudio sugieren una baja significación del genotipo TT y del alelo T en la aparición de los defectos del tubo neural; sin embargo, se recomienda para futuros estudios, incrementar el número de muestras e incluir datos de factores externos tales como consumo de ácido fólico, toma de medicamentos y exposición a teratógenos en el período periconcepcional de las madres de los pacientes y casos.
 Resumen
Resumen
Existe un gen implicado en la etiología de los defectos del tubo neural (DTN) que codifica para la enzima 5,10-metiltetrahidrofolato reductasa (MTHFR), la cual participa en el metabolismo del folato y la homocisteina. El polimorfismo C677T de la MTHFR trae como consecuencia termolabilidad y baja actividad específica de la enzima. El objetivo de este trabajo fue la evaluación del polimorfismo C677T del gen MTHFR en pacientes con DTN y controles del suroccidente colombiano. Lo anterior se realizó evaluando una muestra de 30 individuos con espina bíifida provenientes de hospitales de la ciudad de Cali y 60 controles. El análisis molecular se llevó a cabo mediante la técnica PCR-RFLP y la determinación de la asociación se realizó calculando el OR (IC 95%) mediante el programa estadístico Stata. La población se encontró en equilibrio H-W (p = 0.42), al igual que las poblaciones de casos y controles y por separado (p = 0.63 y p = 0.73, respectivamente). No se encontraron diferencias significativas para las distintas comparaciones: homocigota heterocigota, modelo dominante y modelo recesivo, para el polimorfismo C677T, ni para el OR ajustado según sexo y edad. Estos datos sugieren una baja significación del genotipo TT y del alelo T en el desarrollo de DTN, sin embargo no se encontraron diferencias significativas al comparar los resultados con los obtenidos en otro estudios de Colombia. Se infiere un comportamiento por etnicidad por parte del polimorfismo C677T y para estudios posteriores se sugiere aumentar el tamaño de muestra y considerar factores externos, tales como el consumo de acido fólico.
 Palabras clave
Palabras clave
defectos del tubo neural, espina bífida, 5-metiltetrahidrofolato-homocisteína s-metiltransferasa, reacción en cadena de la polimerasa, polimorfismo de longitud del fragmento de restricción
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/157060
Especialidades
 Principal: Diagnóstico por Laboratorio, Genética Humana,
Principal: Diagnóstico por Laboratorio, Genética Humana,
 Relacionadas: Bioquímica, Epidemiología, Medicina Farmacéutica,
Relacionadas: Bioquímica, Epidemiología, Medicina Farmacéutica,
 Enviar correspondencia a:
Enviar correspondencia a:
Diana Carolina Ortega Ortega, Cali, Colombia
C677T POLYMORPHISM IN PATIENTS WITH NEURAL TUBE DEFECTS
 Abstract
Abstract
Neural tube defects (NTDs) are the most common malformations of the central nervous system, caused by partial or complete failure of the neural tube to close. There is a gene involved in the etiology of NTDs coding for the enzyme 5,10-methylenetetrahydrofolate reductase (MTHFR), which is involved in folate and homocysteine metabolism. The MTHFR C677T polymorphism results in thermolability and low specific activity of the enzyme. We evaluated the MTHFR C677T polymorphism in patients with neural tube defects from south-western Colombia, 30 patients and 60 controls. It was done by evaluating a sample of 30 individuals with spine bifida from Valle del Cauca and 60 controls. Molecular analysis was performed by PCR.-RFLP technique and determination of the association was performed by calculating the OR (IC 95%) using the STATA statistical program. The population was found in HW equilibrium (p = 0.42), as the case-control populations separately (p = 0.63 and p = 0.73, respectively). No significant differences were found to different comparisons: Heterozygous, homozygous, dominant model, and recessive model for C677T polymorphism or for adjusted OR to age and sex. These data suggest a low significance of TT genotype and T allele in the development of NTD in the Valle del Cauca, however, not significant when comparing the results with those obtained in other studies of Colombia differences. Behavior is inferred by ethnicity by the C677T polymorphism and subsequent studies suggested increasing the sample size and consider external factors such as folic acid consumption factors.
 Key words
Key words
neural tube defects, restriction fragment length polymorphism, polimerase chain reaction, methylenetetrahydrofolate reductase, spina bifida
POLIMORFISMO C677T EN PACIENTES CON DEFECTOS DEL TUBO NEURAL
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
Los defectos del tubo neural (DTN) son anomalías congénitas que tienen lugar en estadios tempranos del embarazo. El defecto embriológico se produce entre la tercera y sexta semana de gestación, causado por una falla total o parcial de los nervios en el cierre del tubo neural.1 Los tres tipos más comunes de DTN son espina bífida, anencefalia y encefalocele.2
En la espina bífida existe un fallo en la fusión de los arcos vertebrales, generalmente en la región lumbar, y su gravedad varía desde un defecto limitado sólo al arco óseo (espina bífida oculta) hasta un defecto óseo asociado con meningocele y mielomeningocele (espina bífida abierta); en la anencefalia, el cerebro anterior, las meninges que lo recubren y la bóveda craneal están ausentes; y en el encefalocele, existe un protrusión de la corteza cerebral y las meninges a través de una abertura en el cráneo que puede localizarse en cualquier posición de este.3,4 Los DTN afectan de 1 a 2 de cada 1000 nacimientos. Sin embargo, su incidencia varía en los diferentes grupos poblacionales, según su nivel socioeconómico, estado nutricional y factores genéticos y ambientales.2,9 En Colombia se informó una prevalencia de 9.9 por cada 10 000 nacimientos entre los años 2001 y 2007,5 y en Cali, específicamente, se estimó una prevalencia de DTN de 16.66 por cada 10 000 nacimientos entre los años 2004 y 2008.6
Los DTN tienen origen multifactorial con susceptibilidad poligénica y factores de riesgo ambientales, tales como la deficiencia de folato.7 Muchos estudios han permitido establecer que el consumo de ácido fólico (o vitamina B12) en la etapa periconcepcional ejerce un papel protector sobre los defectos del tubo neural.8 Investigaciones han mostrado que la mayoría de las mujeres con embarazos afectados e hijos con defectos del tubo neural presentan niveles plasmáticos elevados de homocisteína y concentraciones disminuidas de folato y vitamina B12 en sangre.9 Existe un gen implicado en la etiología de los DTN que codifica para la enzima 5,10-metiltetrahidrofolato reductasa (MTHFR), la cual participa en el metabolismo del folato y la homocisteína, y se localiza en el brazo corto del cromosoma 1 (1p36.3). En 1994 fue hallado el polimorfismo más frecuente del gen MTHFR, el C677T, indicando un SNP en la posición 677 del exón 4, donde ocurre una transición de citosina por timina, y un cambio del aminoácido alanina por valina en el dominio catalítico de la enzima.10
La actividad enzimática de los heterocigotos (CT) es del 65%, y del 30% para los homocigotos (TT), con respecto al alelo mayor (CC).11 Diferentes investigaciones han asociado el genotipo MTHFR-TT con la hipometilación del ADN, particularmente en individuos con concentraciones reducidas de folato en plasma. Además, metanálisis implican enormemente al genotipo homocigoto como un factor de riesgo en madres (incremento del 50% al 70%) y en fetos (80% a 90%).2 Asimismo, la presencia de este genotipo se asocia con la presencia una moderada hiperhomocisteinemia, disminución de la concentración de folatos en plasma (y una menor respuesta a la suplementación de estos), disminución de la metilación del ADN genómico y un factor de riesgo para presentar DTN, así como otras enfermedades (coronariopatías, cardiopatías congénitas, algunos tipos de cáncer, etcétera).11,12
Diversos estudios de casos y controles han encontrado una asociación entre la presencia del polimorfismo C677T y la presencia de DTN.13-20 En un metanálisis de 85 estudios de casos y controles, donde 42 estudios fueron para el polimorfismo C677T, 4374 casos y 7232 controles se encontró asociación significativa entre el polimorfismo y la susceptibilidad al DTN (TT CT vs. CC: odds ratio [OR] = 1.23; intervalo de confianza [IC] del 95%: 1.07 a 1.42).21 Por otro lado, también se encontró asociación en un estudio con madres, donde un metanálisis de 25 ensayos de casos y controles con un total 5999 madres (2429 casos y 3570 controles) se encontró asociación significativa entre el polimorfismo C677T MTHFR y la susceptibilidad elevada de presentar el DTN (TT vs. CC: OR = 2.022; IC 95%: 1.508 a 2.712). Un aumento de riesgo de DTN fue encontrado después de la estratificación de los datos de la variante MTHFR C677T por etnicidad y origen de los controles.22
Al ser entonces los DTN en los seres humanos un ejemplo clásico de un trastorno multifactorial, se hace indispensable la identificación y caracterización de los distintos factores genéticos los cuales pueden estar jugando un papel clave en el mecanismo del cierre del tubo neural. El objetivo de este estudio fue la evaluación del polimorfismo C677T en pacientes con DTN y controles para la población del suroccidente colombiano.
Materiales y métodos
Toma de muestra y población de estudio
Se tomó una muestra de 84 individuos (desde los 6 meses a 18 años de edad), en la que 30 fueron casos (personas con espina bífida abierta o cerrada) provenientes de las fundaciones Valle del Lili y Casa de Colombia, y 60 controles (personas sin la enfermedad, sin antecedentes familiares de presentarla y de origen y edad similar a los pacientes), de cualquier edad y sexo. Los criterios de inclusión para los casos incluyeron: 1) tener un DTN cualquiera con CIE10 diagnosticado en cualquier momento; 2) ser de cualquier edad y sexo; residir en el área de estudio y haber completado el proceso de consentimiento informado. Para los controles: 1) ser del mismo sexo que el caso; 2) tener ± 5 años de edad que el caso; 3) ser del mismo lugar de residencia que el caso; 4) no tener parentesco con el caso (en al menos cuatro generaciones), y 5) haber completado el proceso de consentimiento informado. No se manejaron criterios de exclusión.
Diagnóstico molecular
La extracción de ADN por medio de saliva se llevó a cabo mediante el kit de purificación prepIT-L2p (DNA Genotek). El polimorfismo se determinó por la técnica PCR-RFLP. La mezcla de amplificación de 24 µl de volumen constó de: 1 µl de ADN, buffer Taq 1X, 1.5 mM de MgCl2, 2.5 mM de la mezcla de los cuatro desoxinucleótidos trifosfato (marca Fermentas), 25 pM de cada uno de los cebadores (forward 5’-TGA AGG AGA AGG TGT CTG CGG GA-3’ y reverse 5’- AGG ACG GTG CGG TGA GAG TG- 3’) y 1 U de Taq DNA polimerasa 5 µ/µl. El programa de amplificación se inició con un calentamiento de 1 minuto a 92°C para la desnaturalización, continuando con 50 ciclos así: desnaturalización por 30 segundos a 95°C, seguido de un anillamiento a 45°C por 30 segundos y extensión por 1 minuto a 72°C. Finalmente, una extensión a 72°C por 5 minutos. Los productos de la amplificación fueron digeridos con dos unidades de enzima de restricción HinfI, siguiendo las indicaciones de uso del fabricante (Fermentas). La digestión se llevó a cabo por 16 horas a 37°C. Posteriormente, los fragmentos de ADN resultantes se separaron por electroforesis en gel de poliacrilamida al 8% y serán examinados por tinción con nitrato de plata. Los individuos homocigotos para la mutación presentaron dos fragmentos de 175 pb y 23 pb (genotipo TT); los heterocigotos, dos fragmentos, de 198 pb, y 23 pb, y los individuos sanos presentaron un solo fragmento de 198 pb.
Análisis de datos
Todos los análisis estadísticos se llevaron a cabo con el programa estadístico Stata11®.23 El equilibrio Hardy-Weinberg (H-W) se calculó mediante la prueba de chi al cuadrado y la determinación de la asociación se realizó calculando los odds ratio (OR) con intervalos de confianza del 95% (IC). Los diferentes OR fueron calculados mediante la comparación homocigota (TT vs. CC), la comparación heterocigota (CT vs. CC), el modelo dominante (CT TT vs. CC) y el modelo recesivo (TT vs. CT CC). El genotipo CC fue usado como grupo de referencia en estas comparaciones.
Resultados
Características del estudio
Se analizó un total de 84 individuos pertenecientes al departamento del Valle del Cauca. Veintiocho de ellos fueron casos (26 con mielomeningocele y dos con espina bífida cerrada) y 56 controles. Se obtuvo un total de 30 hombres y 54 mujeres, 66 correspondieron a la ciudad de Cali y 18 a otras ciudades del departamento del Valle (Palmira, Buenaventura y Santander); el rango de edad abarcó desde los 4 meses a los 22 años de edad, los cuales se dividieron en tres grupos para los distintos análisis: 0 a 5 años, 6 a 10 y 11 a 22 años.
La población se encontró en equilibrio H-W (p = 0.42), al igual que las poblaciones de casos y controles y por separado (p = 0.63 y p = 0.73, respectivamente). De estos 84 individuos, el 40% eran genotipo CC (32% en casos y 45% en controles), 48% eran CT (50% casos y 46% controles) y 12% eran TT (18% casos y 9% en controles (Tabla 1).
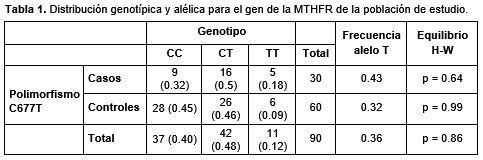
Asociación C677T y DTN
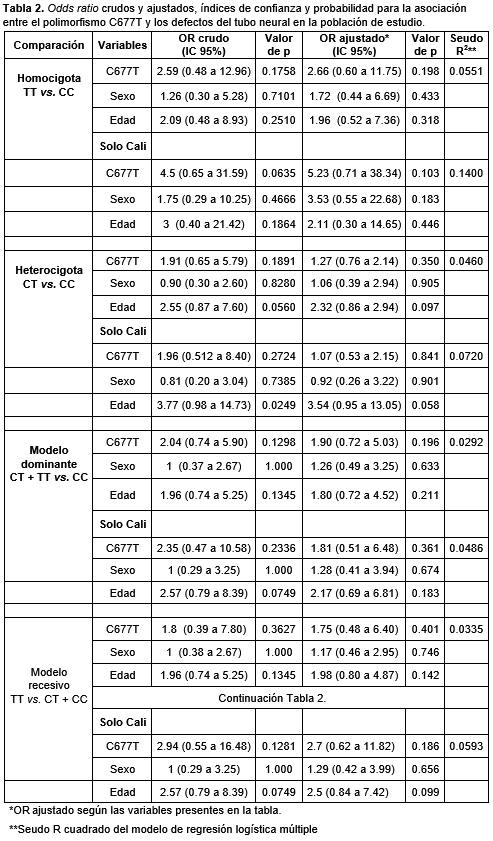
No se encontraron diferencias significativas para las distintas comparaciones: homocigota heterocigota, modelo dominante y modelo recesivo, para el polimorfismo C677T, ni para el OR ajustado según sexo y edad (Tabla 2). Sin embargo, al realizar el mismo análisis con solo la población perteneciente a la ciudad capital (Cali) se observaron valores próximos a la significación, en la comparación homocigota (TT vs. CC: OR ajustado = 5.23; IC 95%: 0.71 a 38.34; p = 0.103) y en el modelo recesivo (TT vs. CT CC: OR ajustado = 2.7; IC 95%: 0.62 a 11.82; p = 0.186).
Discusión
Al comparar las distintas frecuencias genotípicas y alélicas con los resultados obtenidos en dos poblaciones de Bogotá, Colombia,11,16 y una población hispana de la frontera entre Estados Unidos (Texas) y México,24 se encontraron diferencias significativas para ambos grupos (casos y controles) en las frecuencias genotípicas de CC y CT (p = 0.03). Para las frecuencias alélicas, C y T, solo se encontraron diferencias significativas en la población de la frontera Texas-México (p = 0.004). Por otra parte, no se encontraron diferencias significativas en ninguna de las tres poblaciones al comparar las frecuencias genotípicas TT de casos y controles por separado. En estudio realizados en Colombia, la frecuencia del alelo en la población sana varía desde 32% (lo hallado en este estudio), pasando por 43% en Medellín, hasta el 51% en Bogotá.11,16,25-28 Estas frecuencias son considerablemente altas y consistentes con las halladas en la población latinoamericana, y contrastantes con la de otras partes del mundo: la menor frecuencia del alelo T se ha reportado en la población de la India y la africana, y la mayor, en la población hispana.29 La frecuencia del polimorfismo C677T varía en las distintas regiones del mundo, encontrándose valores desde el 1% en la población del suroriente de la India,30 de 0% a 9.4% en población africana,31,32 de 13% a 24% en población asiática,32 del 12% en población afroamericana de los Estados Unidos,33 y en Turquía 13%,34 26% en Holanda,35 y e, Irlanda 29%.18 Las frecuencias más altas para el polimorfismo han sido encontradas en la población latinoamericana, en México y Colombia (45% y 51%, respectivamente),11,36, en Italia (46%), España (54.5%)37 y en el oriente de China (57%).38
La presencia del alelo T, en especial la presencia del genotipo TT, se ha asociado con la disminución de la concentración de folatos en plasma, disminución de la metilación del ADN genómico y un factor de riesgo para presentar DTN; sin embargo esta relación, así como la etiología de los DTN, no ha sido del todo dilucidada. En este estudio, no se encontraron diferencias significativas al realizar las distintas comparaciones (homocigota heterocigota, modelo dominante y modelo recesivo) para el polimorfismo C677T, ni para el OR ajustado según sexo y edad (Tabla 2). Aunque cabe aclarar que el número de muestra fue pequeño, en otros estudios de Colombia y Latinoamérica los resultados concuerdan. En Colombia, solo un estudio realizado en la ciudad de Bogotá mostró diferencias significativas aplicando el modelo recesivo (p = 0.02) en madres con hijos con DTN en comparación con las madres de los controles y entre las díadas DTN vs. controles, pero no se encontraron diferencias significativas al comparar los casos con los controles aplicando los modelos dominante y recesivo.16 En este estudio, al realizar el mismo análisis con solo la población perteneciente a la ciudad capital (Cali) se observaron valores próximos a la significación también aplicando el modelo recesivo (TT vs. CT CC: OR ajustado = 2.7; IC 95%: 0.62 a 11.82; p = 0.186), al igual que en la comparación homocigota (TT vs. CC: OR ajustado = 5.23; IC 95%: 0.71 a 38.34; p = 0.103).
En países de Latinoamérica, la relación entre el polimorfismo y los DTN no ha sido del todo clara. En Chile, no se encontró asociación entre la presencia de polimorfismos entre madres de pacientes con DTN y controles,8 así como en población hispana de la frontera Texas-México que, aunque se reportó una frecuencia elevada del polimorfismo en casos, no fue significativa para el riesgo de DTN.37 Así como en Latinoamérica es poca la asociación con los DTN y alta la frecuencia de este polimorfismo, se ha observado que en países donde la frecuencia de este es baja, tal como el 26% en Holanda,35 9% en el reino Unido,17 29% en Irlanda,18 esa relación es más fuerte. Autores como Papaperou y colaboradores39 sugieren que las frecuencias del alelo T en poblaciones de control de diferentes grupos étnicos son independientes de la incidencia de los DTN en esas poblaciones, destacando que en aquellas poblaciones donde el polimorfismo se ha relacionado con la presencia del DTN, la frecuencia del alelo T en el grupo de controles es relativamente baja (lo que se observa con las poblaciones de Reino Unido, Holanda e Irlanda). Lo contrario ocurre en las poblaciones de Latinoamérica, donde la frecuencia es relativamente alta (mayor del 35%) y la relación del polimorfismo con los DTN no ha sido del todo esclarecida.
Barber y colaboradores36 proponen que este comportamiento de frecuencias según zonas étnicas podría explicarse en parte por la compleja etiología de los DTN. Ya que bajo el modelo multifactorial, la MTHFR representaría solo uno de los grupos de loci que estarían implicados en el incremento de la susceptibilidad a presentar DTN, estos autores proponen la hipótesis que alelos en loci adicionales que se presentan en frecuencias bajas y que también están implicados con la aparición de los DTN, son los alelos críticos que desencadenarían la enfermedad y determinarían así la prevalencia del DTN en la población (en conjunto con determinados factores ambientales).
Contrario a esto, en poblaciones donde la frecuencia del alelo T es baja, el genotipo de la MTHFR sería el que se segregaría en conjunto con el fenotipo de la enfermedad y aquel que mostraría la significación estadística. De acuerdo con lo planteado en este estudio, así como con el desarrollado por Barber y colaboradores, serían esos “alelos raros” los que se segregarían en conjunto con la enfermedad y mostrarían dicha significación36 (alelos que se desconocen y no se están evaluando en el estudio).
Ahora, en los análisis de este estudio no se consideraron otros factores tales como el consumo de acido fólico o la exposición a teratógenos, los cuales, en conjunto con los factores genéticos, se han mostrado como determinantes clave en la disminución o aparición de DTN. En Cali, particularmente, la prevalencia se vio disminuida de 31 a 16.66 en 10 000 nacimientos desde 2004 a 2008, atribuible en parte a la fortificación de harina de trigo con ácido fólico que empezó a llevarse a cabo a cabo en Colombia desde 1996.6,40 Los datos de este estudio sugieren una baja significación del genotipo TT y del alelo T en la aparición de los DTN, sin embargo se recomienda para futuros estudios incrementar el número de muestras e incluir datos de factores externos tales como consumo de ácido fólico, toma de medicamentos y exposición a teratógenos.
Conclusiones
En la muestra de 90 individuos de la población del Valle del Cauca del suroccidente colombiano, no se encontraron diferencias significativas en las distintas comparaciones para el polimorfismo C677T, ni para el OR ajustado según sexo y edad. Tampoco se encontraron diferencias significativas al comparar los resultados con los obtenidos en otros estudios de Colombia. Estos datos sugieren una baja significación del genotipo TT y del alelo T en la aparición de DTN en esta población. Un comportamiento similar ha sido encontrado en otras poblaciones latinoamericanas, donde se hallaron altas frecuencias de este polimorfismo, pero no una relación con los DTN. Por lo tanto, se infiere un comportamiento por etnicidad por parte del polimorfismo C677T, y para estudios posteriores se sugiere aumentar el tamaño de muestra y considerar factores externos, tales como el consumo de ácido fólico.
 Bibliografía del artículo
Bibliografía del artículo
1. Kibar Z, Capra V, Gros P. Toward understanding the genetic basis of neural tube defects. Clin Genet 71:295-310, 2007.
2. Bassuk A, Kibar Z. Genetic basis of neural tube defects. Semin Pediatr Neurol 16:101-10, 2009.
3. Fenichel GM. Clinical Pediatric Neurology: A signs and symptoms approach. Sexta edición, Elsevier Health Sciences España; 2009.
4. Nussbaum RL, Mcinnes RR, Willard HF. Genética en medicina. 7 ed. Elseiver Masson, España; 2008.
5. Suárez F, Ordóñez A, Zarante I. Defectos del tubo neural y ácido fólico: patogenia, metabolismo y desarrollo embriológico. Revisión de la literatura. Rev Colomb Obstet Ginecol 60:49-60, 2010.
6. Pachajoa H, Caicedo CA, Saldarriaga W, Méndez F. Prevalencia de defectos congénitos en un hospital de tercer nivel en Cali, Colombia 2004-2008, asociación con edad materna. Rev Colomb Obstet Ginecol 62:155-160, 2011.
7. Weitkamp LR, Tackels DC, Hunter AG, Holmes LB, Hchwartz CE. Heterozygote advantage of the MTHFR gene in patients with neural-tube defect and their relatives. Lancet 351:1554-5, 1998.
8. Nitsche FV, Alliende MA, Santos JL, Pérez F, María Santa L, Hertrampf E, Cortés F. Frecuencia del polimorfismo C677T de la 5,10-metilentetrahidrofolato reductasa MTHFR en mujeres chilenas madres de afectados con espina bífida y en controles normales. Rev Méd Chile 131:1399-1404, 2003.
9. Jiménez Salas Z, Cantú Martínez PC, Berrún Castañón LN, González Martínez BE. Polimorfismos de la metilentetrahidrofolato reductasa y su asociación con los defectos del tubo neural. Rev Salud Publica Nutr 2:1-6, 2001.
10. Gutiérrez J, Pérez F, Calvo M, Tamparillas M, Romero J. Implicación de los polimorfismos C677T y A1298C del gen MTHFR en el desarrollo de los defectos del tubo neural en la población española. Med Clin 120:441-45, 2003.
11. González Galofre Z, Villegas V, Martínez Agüero M. Determinación del polimorfismo C677T de metilentetrahidrofolato reductasa MTHFR en una población piloto de estudiantes de la Universidad del Rosario, Rev Cienc Salud 8:7-21, 2010.
12. Chen CP. Syndromes, disorders and maternal risk factors associated with neural tube defects IV, Taiwan J Obstet Gynecol 47:141-50, 2008.
13. Mills JL, McPartlin JM, Kirke PN, Lee YJ, Conley MR, Weir DG, Scott JM. Homocysteine metabolism in pregnancies complicated by neural-tube defects. Lancet 345:149-151, 1995.
14. Van der Put NM, Van der Molen EF, Kluijtmans LA, Heil SG, Trijbels JM, Eskes TK, Van Oppenraaij-Emmerzaal D, Banerjee R, Blom HJ. Sequence analysis of the coding region of human methionine synthase: relevance to hyperhomocisteinaemia in neural-tube defects and vascular disease. Q J Med 90:511, 1997.
15. Johanning GL, Wenstrom KD, Tamura T. Changesin frequencies of heterozygous thermolabile 5,10-methylenetetrahydrofolate reductase gene in fetuses with neural tube defects. J Med Genet 39:366-7, 2002.
16. Sopó O. Evaluación de la asociación de los polimorfismos C677T, A1298C de la MTHFR, 844INS68, C699T de la CBS y A66G de la MTHFR con los defectos del tubo neural [tesis de maestría], Bogotá, Colombia: Pontifica Universidad Javeriana; 2011.
17. Shaw GM, Rozen R, Finnell RH, Todoroff K, Lammer EJ. Infant C677T mutation in MTHFR, maternal periconceptional vitamin use, and cleflip. Am J Med Genet 80:196, 1998.
18. Kirke PN, Mills JL, Molloy AM, Brody LC, O'Leary VB, Daly L, et al. Impact of the MTHFR C677T polymorphism on risk of neural tube defects: case-control study. BMJ 328:1535-6, 2004.
19. Relton CL, Wilding CS, Pearce MS, Laffling AJ, Jonas PA, Lynch S, et al. Gene-gene interaction in folate-related genes and risk of neural tube defects in a UK population. J Med Genet 41:256, 2004.
20. Pietrzyk JJ, Bik-Multanowski M, Sanak M, Twardowska M. Polymorphisms of the 5,10-methylenetetrahydrofolate and the methionine synthase reductase genes as independent risk factors for spina bifida. J Appl Genet 44:111, 2003.
21. Zhang T, Lou J, Zhong R, Wu J, Zou L, Sun Y, et al. Genetic variants in the folate pathway and the risk of neural tube defects: a meta-analysis of the published literature. PLoS One 4:8e59570, 2013.
22. Yan L, Zhao L, Long Y, Zou P, Ji G, Gu A, et al. Association of the maternal MTHFR C677T polymorphism with susceptibility to neural tube defects in offsprings: evidence from 25 case-control studies. Plos One 710:e41689, 2012.
23. StataCorp, Stata 11. Base Reference Manual, College Station, TX: Stata Press, 2009.
24. Barber R, Shalat S, Hendricks K, Joggerst B, Larsen R, Suarez L, Finnell R. Investigation of folate pathway gene polymorphisms and the incidence of neural tube defects in a Texas hispanic population. Mol Genet Metab 70:45-52, 2000.
25. Torres JD, Cardona H, Alvarez L, Cardona-Maya W, Castañeda S, Quintero-Rivera F, et al. Inherited thrombophilia is associated with deep vein thrombosis in a Colombian population. Am J Epidemiol 81:933-7, 2006.
26. Cardona H, Cardona-Maya W, Gómez JG, Castañeda SJ, Gómez M, Bedoya G, et al. Relación entre los polimorfismos de la metilentetrahidrofolato-reductasa y los niveles de homocisteína en mujeres con pérdida gestacional recurrente: perspectiva desde la nutrigenética. Nutrición Hospitalaria 23:277-82, 2008.
27. Camacho Vanegas O, Giusti B, Restrepo Fernández CM, Abbate R, Pepe G. Frequency of factor V FV Leiden and C677T methylenetetrahidrofolate reductase MTHFR mutations in Colombians. Thromb Haemost 79:883-4, 1998.
28. Bermúdez M, Briceño I, Gil F, Bernal J. Homocisteína y polimorfismos de cistationina sintasa y metilentetrahidrofolato reductasa en población sana de Colombia. Colombia Médica 37:46-52, 2006.
29. Li DH, Ahmed M, Li YN, Jiao L, Chou TH, Wolff RA, et al. 5,10-methylenetetrahydrofolate reductase polymorphisms and the risk of pancreatic cancer. Cancer Epidemiol Biomarkers Prev 14:1470-6, 2005.
30. Alluri RV, Mohan V, Komandur S, Chawda K, Chaudhuri JR, Hasan Q. MTHFR C677T gene mutation as a risk factor for arterial stroke: a hospital based study. Eur J Neurol 12:40-4, 2005.
31. Pepe G, Vanegas OC, Giusti B, Brunelli T, et al. Heterogeneity in world distribution of the thermolabile C677T mutation in 5,10-methylenetetrahydrofolate reductase. Amer J Hum Genet 63:917, 1998.
32. Schneider JA, Rees DC, Liu YT, Clegg JB. Worldwide distribution of a common methylenetetrahydrofolate reductase mutation. Amer J Hum Genet 62:1258, 1998.
33. Li DH, Ahmed M, Li YN, Jiao L, Chou TH, Wolff RA, et al. 5,10-methylenetetrahydrofolate reductase polymorphisms and the risk of pancreatic cancer. Cancer Epidemiol Biomarkers Prev 14:1470-6, 2005.
34. Ilhan N, Kucuksu M, Kaman D, Ilhan N, Ozbay Y. The 677C/T MTHFR polymorphism is associated with essential hypertension, coronary artery disease, and higher homocysteine levels. Arch Med Res 39:125-30, 2008.
35. Van der Put NM, Steegers-Theunissen RP, Frosst P, Trijbels FJ, Eskes TK, Van den Heuvel LP, et al. Mutated methylenetetrahydrofolate reductase as a risk factor for spina bifida. Lancet 346:1070-71, 1995.
36. Barber R, Shalat S, Hendricks K, Joggerst B, Larsen R, Suarez L, Finnell R. Investigation of folate pathway gene polymorphisms and the incidence of neural tube defects in a Texas hispanic population. Mol Genet Metab 70:45, 2000.
37. Fabris C, Toniutto P, Falleti E, Fontanini E, Cussigh A, Bitetto D, et al. MTHFR C677T polymorphism and risk of HCC in patients with liver cirrhosis: role of male gender and alcohol consumption. Alcohol Clin Exp Res 33:102-7, 2009.
38. Stolzenberg-Solomon RZ, Qiao YL, Abnet CC, Ratnasinghe DL, Dawsey SM, Dong ZW, et al. Esophageal and gastric cardia cancer risk and folate- and vitamin B12-related polymorphisms in Linxian, China. Cancer Epidemiol Biomarkers Prev 12:1222-6, 2003,
39. Papapetrou C, Lynch SA, Burn J, Edwards YH. Methylenetetrahydrofolate reductase and neural tube defects. Lancet 348-58, 1997.
40. Decreto por el cual se reglamenta la fortificación de la harina de trigo y se establecen las condiciones de comercialización, rotulado, vigilancia y control. Decreto 1944 de 1996, Diario Oficial No, 42,909, de 30 de octubre de 1996.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



