|
Coautores
Anchal Malhotra* Deepinder Chhina** Akashdeep Singh**
Médico, Dhiraj Hospital, Piparia, India*
Médico, Dayanand Medical College and Hospital, Ludhiana, India**
|
|
Recepción del artículo: 16 de marzo, 2017
|
|
Aprobación: 23 de agosto, 2017
|
 Conclusión breve
Conclusión breve
La identificación de las especies de Candida es importante ya que las especies no albicans son cada vez más numerosas y resistentes a los fármacos antimicóticos.
 Resumen
Resumen
Introducción: La candidemia se convirtió en una infección importante del torrente sanguíneo que se asocia frecuentemente con índices elevados de mortalidad y morbilidad. Las especies de Candida generan del 70% al 80% de las infecciones micóticas invasivas del torrente sanguíneo y son la cuarta causa más frecuente de infecciones hospitalarias del torrente sanguíneo. La identificación de las especies de Candida es importante, ya que las especies no albicans son cada vez más numerosas y resistentes a las drogas antimicóticas. El objetivo del estudio fue aislar e identificar diferentes especies de Candida asociadas con candidemia y analizar su patrón de susceptibilidad a los antimicóticos. Materiales y métodos: Los pacientes con sospecha de infecciones del torrente sanguíneo (ITS) fueron reclutados durante un período de un año para el estudio prospectivo. Se analizaron las características demográficas, la duración de la internación y los factores de riesgo asociados y la evolución clínica. El análisis de las muestras de sangre tuvo lugar mediante el sistema automatizado BacTAlert. La identificación y la susceptibilidad antimicótica de las levaduras fueron realizadas mediante el uso de dispositivo VITEK-2. Resultados: Las especies de Candida fueron aisladas en 30 de los 3146 cultivos recibidos (0.9%). La mayoría de los casos de candidemia tuvieron lugar en hombres (66%). Los factores de riesgo más frecuentes fueron el uso de antibióticos de amplio espectro, la vía central y la ventilación mecánica. Entre las levaduras aisladas, las especies de Candida no albicans fueron predominantes (60%), en comparación con la especie C. albicans (40%). La especie albicans presentó una susceptibilidad del 100% a los azoles y la anfotericina, en tanto que las especies no albicans fueron resistentes. De los 30 pacientes mencionados, 5 fallecieron. Conclusión: La prevalencia de Candida no albicans fue mayor en comparación con la prevalencia de Candida albicans. Las especies no albicans fueron más resistentes a los antimicóticos. En consecuencia, los pacientes internados deberían ser evaluados para identificar la candidemia.
 Palabras clave
Palabras clave
candidemia, Candida no albicans, Candida, antimicótico, Candida albicans
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/154072
Especialidades
 Principal: Cuidados Intensivos, Infectología,
Principal: Cuidados Intensivos, Infectología,
 Relacionadas: Administración Hospitalaria, Medicina Interna,
Relacionadas: Administración Hospitalaria, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Veenu Gupta, 141001, Ludhiana, India
Characterization of Candida species in blood stream infections
 Abstract
Abstract
Introduction: Candidemia has become an important bloodstream infection that is frequently associated with high rates of mortality and morbidity. Candida species account for 70-80% of invasive bloodstream fungal infections and represent the fourth most common nosocomial bloodstream infections. The identification of Candida species is important as the number of non albicans Candida species is increasing and they are becoming more resistant to antifungal drugs. The aim of the study was to isolate and identify various Candida species associated with candidemia and to study their antifungal susceptibility pattern. Materials and methods: Patients suspected of having BSI were enrolled on a one-year prospective study. Patient's demographic details, duration of hospital stay, associated risk factors and outcome were studied. Blood samples were analyzed by BacTAlert automated system. Identification and antifungal susceptibility testing of yeasts was done using VITEK-2 compact system. Results: Of 3146 blood cultures received, Candida species were isolated in 30 samples (0.9%). The majority of candidemia cases were in males (66%). The most common risk factors were use of broad spectrum antibiotics, central line and mechanical ventilation. Among the yeast isolates, non albicans Candida species were predominant (60%) compared to C. albicans (40%). Candida albicans showed 100% susceptibility to azoles and amphotericin whereas non albicans Candida species showed resistance. Of these 30 patients, 5 patients died. Conclusion: Prevalence of non albicans Candida was greater than C. albicans and cases were more resistant to antifungal drugs. Therefore surveillance for candidemia should be carried out in hospitalized patients.
 Key words
Key words
candidemia, Candida albicans, non albicans Candida, antifungal, Candida
IDENTIFICACIÓN DE LAS ESPECIES DE CANDIDA EN LAS INFECCIONES SANGUÍNEAS
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
Las infecciones del torrente sanguíneo (ITS) provocadas por diferentes especies de Candida fueron informadas en muchos países y son una causa significativa de morbilidad y mortalidad entre los pacientes hospitalizados. Las infecciones sanguíneas provocadas por Candida constituyen la gran mayoría de las infecciones micóticas hospitalarias. Las especies de Candida representan la cuarta causa más común de infecciones del torrente sanguíneo y la causa principal de infecciones micóticas invasivas en pacientes hospitalizados.1,2 La candidemia es una infección micótica que pone en riesgo la vida del paciente y se asocia con un índice de mortalidad del 38%. Además, prolonga la estadía hospitalaria unos 30 días y aumenta el costo de atención.3 En diferentes estudios retrospectivos se demostró la existencia de factores predisponentes responsables de la diseminación de las infecciones provocadas por Candida en la unidad de cuidados intensivos (UCI).4-6 El uso frecuente de antibióticos, el catéter venoso central y otros dispositivos invasivos, la cirugía abdominal y la internación prolongada en la UCI incrementan el riesgo de infección por Candida.7 Las ITS provocadas por Candida son una causa reconocida de morbilidad y mortalidad entre los pacientes graves. Aunque la mortalidad neta varía entre los estudios, la mayoría de los autores informan porcentajes elevados (39% al 60%) y un exceso de carga económica.8,9
Más del 90% de las infecciones invasivas generadas por Candida se atribuyen a cinco especies: C. albicans, C. glabrata, C. parapsilosis, C. tropicalis y C. krusei. No obstante, la lista de especies nuevas de Candida aisladas de muestras clínicas crece cada año.5 Esto se debe a que los laboratorios de microbiología clínica de todo el mundo emplean métodos de identificación comerciales para complementar los métodos clásicos de identificación. Candida albicans ha sido la especie de Candida aislada con mayor frecuencia en presencia de ITS en todo el mundo. Diferentes programas de vigilancia aplicados en la década de 1990 arrojaron porcentajes de prevalencia de infección por C. albicans que oscilaron entre el 50% (en el programa de vigilancia SENTRY, de 1997-2000) y el 71% (Fungal Disease Registry, Canadá 1992-1994).10 Clásicamente, C. albicans es la causa más frecuente de candidemia a nivel mundial. No obstante, en los últimos años, en algunos estudios se informó un aumento de los casos de candidemia debido a especies de Candida no albicans, con el consiguiente riesgo de incremento de la mortalidad y de la resistencia a los antimicóticos.11,12 En la actualidad, la resistencia intrínseca y emergente a los azoles representa un desafío para la aplicación de estrategias terapéuticas preventivas y empíricas.13
Con la emergencia de especies de Candida no albicans a nivel mundial, especialmente C. glabrata y C. krusei, la resistencia a los antimicóticos se convirtió en uno de los principales motivos de preocupación para el tratamiento de los pacientes con candidemia. La resistencia al fluconazol y a otros azoles es muy elevada entre dichas especies de Candida.5 Otras especies de Candida no albicans, como C. tropicalis y C. parapsilosis tienen un patrón de susceptibilidad variable a los azoles. Existen pocos datos que indiquen la resistencia de las especies de Candida a la anfotericina B y a las equinocandinas.14
La incidencia creciente de candidemia debida a especies no albicans y la emergencia de resistencia a los antimicóticos indican la necesidad de formular un tratamiento empírico para los pacientes con candidemia y para la profilaxis antimicótica de aquellos con riesgo de presentar la infección.15,16
El diagnóstico temprano y oportuno, el tratamiento apropiado y la prevención de la candidemia suponen un desafío importante para los microbiólogos y los médicos en todo el mundo. El conocimiento de la cepa prevalente en la actualidad y de su perfil de resistencia farmacológica son determinantes clave de la selección de la profilaxis antimicótica y del tratamiento empírico. En consecuencia, el estudio fue realizado para definir la prevalencia actual de candidemia entre los pacientes internados en una UCI y el perfil de resistencia antimicótica de las muestras aisladas.
Materiales y métodos
Durante un año de estudio prospectivo (junio de 2014 a mayo de 2015) en el Dayanand Medical College & Hospital, se reclutaron los pacientes con sospecha de ITS internados en diferentes UCI. Se estudiaron las características demográficas de los pacientes como la edad y el sexo, la duración de la internación, los factores de riesgo asociados como el uso de un catéter venoso central, la ventilación mecánica, el tratamiento con esteroides, la nutrición parenteral total, las enfermedades con compromiso inmunitario como la diabetes o el cáncer y la evolución clínica.
Las muestras de sangre fueron tomadas en todos los pacientes con las precauciones de asepsia pertinentes. Los cultivos de sangre y líquidos se realizaron mediante los sistemas automatizados Bac-T alert y Bactec. Los recipientes para el cultivo sanguíneo se incubaron hasta la obtención de una marcación positiva por parte del sistema o un período máximo de siete días. Las muestras provenientes de los cultivos positivos fueron extendidas y evaluadas mediante la tinción de Gram, subcultivadas en el medio agar dextrosa de Sabouraud (ADS) e incubadas en un entorno aeróbico a 37 °C durante 24 a 48 horas. Las muestras de Candida, caracterizadas por colonias de apariencia lisa, cremosa y pastosa en el medio ADS, se evaluaron para su determinación específica mediante la prueba del tubo germinal y de fermentación de azúcares. El episodio de candidemia fue identificado ante el aislamiento de Candida en el cultivo de sangre del paciente. Para identificar las levaduras se emplearon las tarjetas YST procesadas por el dispositivo VITEK-2. La susceptibilidad de las levaduras ante los antimicóticos fue analizada de acuerdo con las recomendaciones del Clinical & Laboratory Standards Institute (CLSI) mediante el uso de las tarjetas YST-AST que contienen anfotericina B, fluconazol, voriconazol, caspofungina y flucitosina.17 Los datos fueron analizados desde el punto de vista estadístico para conocer las diferencias entre los subgrupos mediante la prueba de la Z de comparación de proporciones. Un valor de p < 0.05 fue considerado estadísticamente significativo. Las cuestiones éticas se evaluaron de acuerdo con los criterios del Institutional Ethics Committee.
Resultados
Las especies de Candida fueron aisladas en 30 (0.9%) casos de los 3146 cultivos de sangre recibidos en nuestro laboratorio durante el período de estudio. De esos 30 pacientes con candidemia, el 66% eran hombres, y el 34%, mujeres. La edad de los pacientes que presentaron candidemia varió entre 19 y 88 años, con una media de 51.6 años (Figura 1).
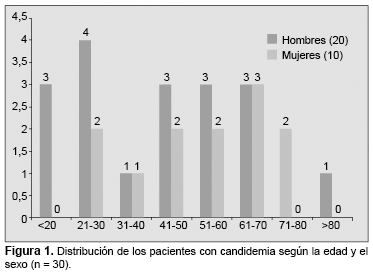
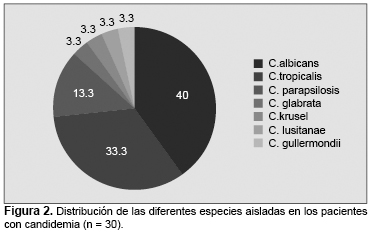
La duración de la internación en la UCI fue de entre 4 y 92 días, con una media de 22.8 días. Los factores de riesgo más frecuentes fueron el cateterismo urinario (90%), el uso de antibióticos de amplio espectro (90%), la vía central (70%) y la ventilación mecánica (46.7%). De los 30 casos de candidemia, 22 fueron primarios, en tanto que ocho presentaron candiduria concomitante (seis casos) e infección tisular leve (dos pacientes). Entre las levaduras aisladas predominaron las especies de Candida no albicans (60%), en comparación con C. albicans (40%). Entre las especies no albicans, C. tropicalis fue la más frecuente, seguida por C. parapsilosis (Figura 2). Los cultivos de Candida presentaron resistencia al fluconazol en el 13.8% de los casos y resistencia al voriconazol, a la caspofungina y a la anfotericina B con una frecuencia del 3.4% para cada droga, en tanto que todos los cultivos fueron susceptibles a la flucitosina (Tabla 1).

Candida albicans presentó un 100% de susceptibilidad al voriconazol, al fluconazol y a la anfotericina, en tanto que las especies de Candida no albicans presentaron resistencia al fluconazol (23.6%), al voriconazol (5.6%) y a la anfotericina (5.6%). Entre los cultivos de Candida no albicans, C. glabrata, C. krusei, C. guilliermondii y C. lusitaniae no presentaron resistencia a los antimicóticos evaluados. Candida albicans mostró resistencia a la caspofungina (8.4%) en comparación con las especies de Candida no albicans. Candida no albicans presentó una resistencia elevada y casi significativa al fluconazol y a la anfotericina B (Tabla 2). De los 30 pacientes, 25 fueron dados de alta en condiciones satisfactorias, en tanto que cinco fallecieron (16.6%).

Discusión
La prevalencia de especies de Candida en las ITS de los pacientes internados en la UCI fue del 0.9%, al igual que lo informado por Giri y colaboradores (0.65%).18 No obstante, algunos autores informaron prevalencias superiores, del 6%,19 16%20 y 18%.21
En nuestro estudio, la edad de los pacientes con candidemia fue de entre 19 y 88 años, con una media de 51.6 años. Los resultados de otras investigaciones fueron similares. Por ejemplo, León y colegas informaron una media de edad de 60 años, y Laupland y su grupo informaron una media de 57.8 años en su estudio de cinco años de duración sobre las infecciones invasivas provocadas por Candida.22,23 En nuestro estudio, los hombres fueron más numerosos que las mujeres, con una relación entre los dos sexos de 2:1, respectivamente. Los resultados coincidieron con lo informado en otras investigaciones sobre el predominio de los pacientes de sexo masculino.22,24,25 Los factores de riesgo más frecuentes asociados con la candidemia fueron la cateterización urinaria (90%), el uso de antibióticos de amplio espectro (90%), la vía central (70%) y la ventilación mecánica (46.7%), al igual que lo informado en otros trabajos18 en los que el tratamiento antibiótico a largo plazo (64.1%), el uso de un catéter venoso central (56.4%) y de un catéter urinario (53.9%) fueron factores de riesgo frecuentes.
En nuestro estudio se observó un porcentaje más elevado de Candida no albicans (60%). En cambio, C. albicans fue el agente predominante en diferentes investigaciones (50%, 53%, 64.3%).20,26,27
Candida albicans (40%) fue el agente aislado más frecuentemente en los casos de candidemia, seguido por C. tropicalis (33.3%). Los resultados fueron similares a los hallados en un estudio realizado en el norte de India por Gupta y colaboradores, donde C. albicans (50%) fue el organismo aislado con mayor frecuencia, en tanto que el encontrado menos frecuentemente fue C. tropicalis (8.3%).20 Sin embargo, Chander y colegas y Giri y su equipo obtuvieron resultados diferentes, ya que C. tropicalis fue el patógeno más frecuente (40.7%, 74.3%) seguido por C. albicans (29.6%, 10.2%).18,28
En nuestro estudio, los cultivos de Candida presentaron resistencia al fluconazol (13.8%,), al voriconazol (3.4%) y a la anfotericina B (3.4%). La resistencia al fluconazol fue comparable frente a la hallada en trabajos realizados en el AIIMS (11.7%)19 y en Chennai (17.2%),29 en tanto que Gupta y colegas informaron un nivel mayor de resistencia (30.8%, 36%, 50%)18,20,21 y otros autores comunicaron una resistencia baja al fluconazol (4.5%, 4.9%).30,31 Diferentes autores no informaron resistencia a la anfotericina B en cultivos de Candida, en tanto que Kothari y colaboradores y Chander y su grupo informaron un 8% de resistencia en el 18.5% de los cultivos.21,28
Candida albicans presentó un 100% de susceptibilidad al fluconazol, al voriconazol y a la anfotericina. En cambio, en otros estudios se informó un nivel elevado de resistencia al fluconazol (33.3%) y al voriconazol (16.6%).20 Las especies de Candida no albicans presentaron resistencia al fluconazol (23.6%), al voriconazol (5.6%) y a la anfotericina B (5.6%), mientras que en otros trabajos se informó una resistencia del 33.3%, del 66.7% y de 0%, respectivamente.20
Para concluir, en nuestro estudio predominaron las especies de Candida no albicans, las cuales mostraron un nivel mayor de resistencia en comparación con C. albicans. La candidemia es un problema significativo y creciente en pacientes hospitalizados, especialmente en la UCI. Existen diferentes factores de riesgo que contribuyeron al aumento de la frecuencia de candidemia. El incremento de la resistencia a los antimicóticos en los cultivos de Candida resultó en un aumento de la mortalidad y la morbilidad. La detección sistemática de rutina de las especies de Candida, seguida por la confirmación de las cepas resistentes mediante pruebas de sensibilidad a los antimicóticos es fundamental y puede ser de ayuda para elaborar recomendaciones preventivas y terapéuticas y mejorar la atención.
 Bibliografía del artículo
Bibliografía del artículo
1. Bouza E, Munoz P. Epidemiology of candidemia in intensive care units. Int J Antimicrob Agents 32:87-91, 2008.
2. Cortes JA, Reyes P, Gomez CH, Cuervo SI, Rivas P, Casas CA, et al. Clinical and epidemiological characteristics and risk factors for mortality in patients with candidemia in hospitals from Bogotá, Colombia. Braz J Infect Dis 18:631-637, 2014.
3. Wey SB, Mori M, Pfaller MA, Woolson RF, Wenzel RP. Hospital acquired candidemia. The attributable mortality and excess length of stay. Arch Intern Med 148:2642-2645, 1988.
4. Méan M, Marchetti O, Calandra T. Bench-to-bedside review: Candida infections in the intensive care unit. Crit Care 12:204, 2008.
5. Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem. Clin Microbiol Rev 20:133-163, 2007.
6. Lagrou K, Verhaegen J, Peetermans WE, De RT, Maertens J, Van WE. Fungemia at a tertiary care hospital: incidence, therapy, and distribution andantifungal susceptibility of causative species. Eur J Clin Microbiol Infect Dis 26:541-547, 2007.
7. Schelenz S. Management of candidiasis in the intensive care unit. J Antimicrob Chemother 61:31-34, 2008.
8. Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB. Nosocomial bloodstream infections in US hospitals: Analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Infect Dis 39:309-317, 2004.
9. Zaoutis TE, Argon J, Chu J, Berlin JA, Walsh TJ, Feudtner C. The epidemiology and attributable outcomes of candidemia in adults and children hospitalized in the United States: A propensity analysis. Clin Infect Dis 41:1232-1239, 2005.
10. Yamamura DL, Rotstein C, Nicolle LE, Loannou S. The fungal disease registry of the canadian infectious disease society. Candidemia at selected canadian sites: Results from the Fungal Disease Registry, 1992-1994. Can Med Assoc J 160:493-499, 1999.
11. Oberoi JK, Wattal C, Goel N, Raveendran R, Datta S, Prasad K. Non-albicans Candida species in blood stream infections in a tertiary care hospital at New Delhi, India. Indian J Med Res 136(6):997, 2012.
12. Magill SS, Shields C, Sears CL, Choti M, Merz WG. Triazole cross-resistance among Candida spp.: case report, occurrence among bloodstream isolates, and implications for antifungal therapy. J Clin Microbiol 44(2):529-535, 2006.
13. Leroy O, Gangneux JP, Montravers P, Mira JP, Gouin F, Sollet JP et al. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005-2006). Crit Care Med 37(5):1612-1618, 2009.
14. Krogh-Madsen M, Arendrup MC, Heslet L, Knudsen JD. Amphotericin B and caspofungin resistance in Candida glabrata isolates recovered from a critically ill patient. Clin Infect Dis 42:938-944, 2006.
15. Parkins MD, Sabuda DM, Elsayed S, Laupland KB. Adequacy of empirical antifungal therapy and effect on outcome among patients with invasiveCandida species infections. J Antimicrob Chemother 60:613-618, 2007.
16. Armstrong JD. Invasive Candida species infection: the importance of adequate empirical antifungal therapy. J Antimicrob Chemother 60:459-460, 2007.
17. Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts: approved standard, 3rd ed., M27-A3. Clinical and Laboratory Standards Institute, Wayne, PA, 2008.
18. Giri S, Kindo AJ, Kalyani J. Candidemia in intensive care unit patients: A one year study from a tertiary care center in South India. JPGM 59(3):190-195, 2013.
19. Xess I, Jain N, Hasan F, Mandal P, Banerjee U. Epidemiology of candidemia in a tertiary care centre of north India: 5-year study. Infection 35:256-259, 2007.
20. Gupta P, Prateek S, Chatterjee B, Kotwal A, Singh AK, Mittal G. Prevalence of candidemia in ICU in a tertiary care hospital in North India. Int J Curr Microbiol App Sci 4(6):566-575, 2015.
21. Kothari A. Sagar V. Epidemiology of Candida bloodstream infections in a tertiary care institute in India. Indian J Med Microbiol 27:171-172, 2008.
22. León C, Ruiz-Santana S, Saavedra P, Galván B, Blanco A, Castro C, et al. Usefulness of the Candida score for discriminating between Candida colonization and invasive candidiasis in non-neutropenic critically ill patients: a prospective multicenter study. Crit Care Med 37:1624-1633, 2009.
23. Laupland KB, Gregson DB., Church DL, Ross T, Elsayed S. Invasive Candida species infections: a 5 year population-based assessment. J Antimicrob Chemother 56:532-537, 2000.
24. Ylipalossari P, Ala-Kokko T, Karhu J, Koskela M, Laurila J, Ohtonen P, et al. Comparison of the epidemiology, risk factors, outcome and degree of organ failures of patients with candidemia acquired before or during ICU treatment. Crit Care 16:R62, 2012.
25. Gonzalez de Molina FJ, León C, Ruiz Santana S, Saavedra P. Assessment of candidemia-attributable mortality in critically ill patients using propensity score matching analysis. Crit Care 16:R105, 2012.
26. Leroy G, Lambiotte F, Thevenin D, Lemaire C, Parmentier E, Devos P, et al. Evaluation of "Candida score" in critically ill patients: a prospective, multicenter, observational, cohort study. Ann Intensive Care 1:50, 2011.
27. Dimopoulos G, Ntziora F, Rachiotis G, Armaganidis A, Falagas ME. Candida albicans versus non-albicans intensive care unit-acquired bloodstream infections: differences in risk factors and outcome. Anesth Analg 106:523-9, 2008.
28. Chander J, Singla N, Sidhu SK, Gombar S. Epidemiology of Candida blood stream infections: experience of a tertiary care centre in North India. J Infect Dev Ctries 7:670-675, 2013.
29. Kumar CP, Sundararajan T, Menon T, Venkatadesikalu M. Candidiosis in children with onco-hematological diseases in Chennai, south India. Jpn J Infect Dis 58:218-221, 2005.
30. Goel N, Ranjan PK, Aggarwal R, Chaudhary U, Sanjeev N. Emergence of nonalbicans Candida in neonatal septicemia and antifungal susceptibility: Experience from a tertiary care center. J Lab Physicians 1:53-55, 2009.
31. Capoor MR, Nair D, Deb M, Verma PK, Srivastava L, Aggarwal P. Emergence of non-albicans Candida species and antifungal resistance in a tertiary care hospital. Jpn J Infect Dis 58:344-348, 2005.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



