|
|
Recepción del artículo: 23 de septiembre, 2016
|
|
Aprobación: 12 de octubre, 2016
|
 Conclusión breve
Conclusión breve
La medición del nivel de melatonina no es un biomarcador útil de depresión. No se cuenta con fundamentos adecuados para indicar la existencia de un subtipo de depresión asociado con un nivel bajo de melatonina. Los perfiles nocturnos de melatonina pueden ser útiles para identificar los pacientes con anormalidades de las fases circadianas. El entrenamiento del sistema circadiano puede ser de ayuda para la recuperación de los pacientes con episodios de trastorno depresivo mayor. No obstante, la melatonina y los agonistas melatoninérgicos no son útiles para la monoterapia de los pacientes con trastorno depresivo mayor. Los beneficios terapéuticos de la agomelatina en pacientes con depresión se deben al agonismo melatoninérgico y al antagonismo 5HT2C.
 Resumen
Resumen
Introducción: Los trastornos de los ritmos estacionales y circadianos en pacientes con melancolía se describen desde la antigüedad. Sin embargo, la caracterización fisiológica de los ritmos circadianos endógenos fue posible a partir de la era moderna. Las características fenomenológicas de la depresión mayor, así como la evaluación de los ritmos circadianos, brindan fundamentos para la elaboración de una hipótesis etiológica circadiana de la enfermedad. La lógica sugeriría que la adecuación de los ritmos circadianos mediante estrategias farmacológicas o fisiológicas resultaría en el alivio de los síntomas de la enfermedad. Métodos: El presente estudio evalúa, en forma crítica, en qué medida los cambios de los ritmos circadianos permiten modificar los síntomas de depresión, de acuerdo con la información publicada. Resultados: La melatonina puede adelantar o retrasar los ritmos circadianos según el momento de administración. Su uso en presencia de trastornos del estado de ánimo es analizado en forma breve. La creación de un agonista farmacológico de la melatonina, la agomelatina, brindó una forma alternativa de manipulación circadiana en pacientes con depresión mayor. También se presenta una evaluación breve de los estudios clínicos sobre su eficacia en pacientes con depresión mayor. Los efectos terapéuticos de esta droga reflejan en qué medida puede considerarse el surgimiento de la depresión sobre la base exclusiva de la presencia de trastornos circadianos. La realización de estudios en modelos preclínicos brindó información sobre las acciones adicionales de la medicación que también podrían contribuir con sus efectos antidepresivos. Conclusiones: Si bien los datos disponibles coinciden con la idea de que el reentrenamiento de los ritmos circadianos es necesario para la recuperación de los pacientes con depresión, esto no constituiría una condición suficiente.
 Palabras clave
Palabras clave
melatonina, agomelatina, ritmo circadiano, agonistas de la melatonina, antidepresivos
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/147097
Especialidades
 Principal: Farmacología, Salud Mental,
Principal: Farmacología, Salud Mental,
 Relacionadas: Atención Primaria, Bioquímica, Farmacología, Medicina Familiar, Medicina Farmacéutica,
Relacionadas: Atención Primaria, Bioquímica, Farmacología, Medicina Familiar, Medicina Farmacéutica,
 Enviar correspondencia a:
Enviar correspondencia a:
Trevor Ronald Norman, Heidelberg, Australia
Therapeutic Benefits of Agomelatin in Patients with Depression
 Abstract
Abstract
Introduction: Alterations of seasonal and circadian rhythms in melancholia have been described since antiquity. Only since the modern era has it been possible to physiologically characterise endogenous circadian rhythms. Phenomenological features of major depression, as well as measurement of endocrine rhythms, provide support for a circadian aetiological hypothesis of the disorder. Logic would suggest that adjustment of circadian rhythms, either pharmacologically or physiologically, should result in the alleviation of the symptoms of the disorder. Methods: This paper critically assesses the extent to which known circadian shifting modalities can modify the symptoms of depression based on published data. Results: Melatonin is capable of either advancing or delaying circadian rhythms depending on the timing of its' administration. The use in mood disorders is briefly reviewed. Development of the pharmacological melatonin agonist, agomelatine, has provided an alternative means of circadian manipulation in major depression. A brief overview of clinical studies evaluating its efficacy in major depression is also presented. At the heart of the therapeutic effects of this medication is the extent to which it can be considered to arise from circadian alterations alone. Studies in pre-clinical models have provided an insight into additional actions of the medication which might also contribute to its' antidepressant effects. Conclusions: While the evidence supports the notion that re-entrainment of the circadian rhythm is necessary for recovery from depression, it may not be a sufficient condition.
 Key words
Key words
melatonin, agomelatine, circadian rhythm, melatonin agonist, antidepressant
BENEFICIOS TERAPÉUTICOS DE LA AGOMELATINA EN PACIENTES CON DEPRESIÓN
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
Algunos de los síntomas clínicos asociados con la depresión mayor pueden coincidir con las características principales de la alteración de los ritmos circadianos. En particular, la depresión se asoció con una amplia variedad de síntomas relacionados con el ciclo sueño-vigilia, como la fatiga y los cambios diurnos del estado de ánimo.1 Las variaciones diurnas marcadas del estado de ánimo y el despertar matutino precoz se asocian frecuentemente con la melancolía. El adelanto de fase relacionado con las variaciones diurnas de la actividad, por ejemplo, se observa en pacientes con melancolía. Las depresiones “atípicas” se asocian con una probabilidad mayor de inicio y finalización tardíos del sueño y con períodos de sueño prolongado, cansancio y fatiga diurna. Dichas alteraciones de los patrones sintomáticos sugieren un retraso de fase subyacente en el sistema circadiano.1 Además, existe información que indica la alteración de las funciones fisiológicas en presencia de trastorno depresivo mayor (TDM). También se informaron patrones alterados de liberación circadiana de adrenocorticotrofina (ACTH), cortisol y tirotrofina (TSH).2 Los cambios de los patrones de liberación hormonal en general coinciden con un adelantamiento de fase de ritmos circadianos o al menos con la pérdida de su sincronización con otros ritmos diurnos. La hipótesis circadiana del TDM fue detallada en diferentes publicaciones previas.3-6
La presente revisión evalúa en qué medida las drogas que modifican el sistema circadiano pueden ser clínicamente útiles como antidepresivos. El objeto de evaluación fueron la melatonina y los agonistas melatoninérgicos, ya que es sabido que la melatonina se asocia en forma significativa con los ritmos circadianos. Más aun, las anormalidades de los patrones de secreción de la melatonina pueden resultar en la aparición de trastornos del ciclo de 24 horas, o ser una consecuencia de ellos.
Melatonina y depresión
Los ritmos circadianos de los mamíferos son regulados principalmente por un reloj biológico localizado en el núcleo supraquiasmático (NSQ) hipotalámico. Su actividad de marcapasos es regulada por la luz y por vías de modulación no fóticas.7 El mensaje neural circadiano es distribuido hacia la glándula pineal, que lo transforma en un mensaje humoral circadiano transmitido por la melatonina, la cual a su vez modula la actividad celular en tejidos que expresan receptores melatoninérgicos.8 La medición de las concentraciones de melatonina en pacientes con TDM puede ser indicadora de anormalidades de importancia etiológica para el trastorno. Además, la producción de melatonina resulta de procesos catalizados por enzimas y dependientes de la función de la noradrenalina, neurotransmisor asociado íntimamente con la etiología del TDM.
En la Tabla 1 se presenta un resumen de los estudios en los cuales se evaluó la secreción de melatonina en pacientes con TDM. La hipótesis plantearía un cambio de fase circadiana en el ritmo melatoninérgico. La mayoría de los estudios realizados hasta el momento no fueron diseñados específicamente para evaluar los cambios de fase circadiana. En general incluyeron la evaluación del nivel de melatonina secretado durante una noche o durante un intervalo de 24 horas. La evaluación de las anormalidades asociadas con el TDM también tuvo lugar según la excreción urinaria del metabolito de la melatonina 6-sulfatoxi melatonina (aMT6s), la curva de concentración sérica en función del tiempo correspondiente al nivel nocturno de melatonina o la comparación de las concentraciones plasmáticas o séricas de melatonina en un determinado momento de la noche.
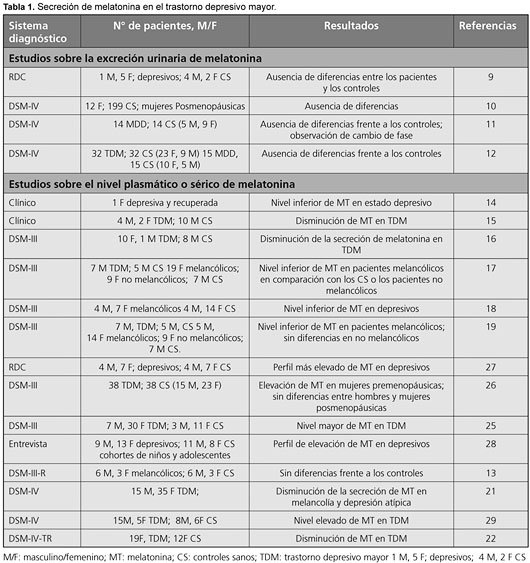
La medición de las concentraciones de melatonina no sería un biomarcador fiable de la enfermedad depresiva. El patrón de excreción urinaria de melatonina en 24 horas no diferiría entre los pacientes con depresión y los controles sanos.9-12 Los cambios de fase no son apreciables mediante evaluaciones de la secreción urinaria total en 24 horas, ya que la secreción puede ser constante, en tanto que la alteración del tiempo transcurrido hasta el inicio y la finalización de la acción de la melatonina pueden modificarse. En un estudio se observó un adelantamiento de fase del ritmo melatoninérgico, aunque la cantidad reducida de participantes impidió la obtención de conclusiones definitivas.13 La mayoría de los estudios independientes informaron una disminución de la secreción nocturna de melatonina en pacientes con TDM, en comparación con los controles sanos mediante el uso de diferentes metodologías.14-22 Dichos trabajos se llevaron a cabo con pocos pacientes, con lo cual pueden incluir errores de tipo I. De todos modos, los hallazgos llevan a proponer que la “disminución de la secreción de melatonina” puede considerarse un marcador de rasgo asociado con la depresión.23 Esta hipótesis no estaría fundamentada mediante estudios controlados adecuados en los cuales se tengan en cuenta los factores que influyen sobre la secreción nocturna de melatonina. Por el contrario, en diferentes estudios se informó un aumento de la secreción nocturna de melatonina en pacientes con TDM.24-29 No obstante, en un estudio más reciente se evaluó la relación entre el ángulo de fase del cortisol y el inicio de la secreción nocturna de melatonina (dim light melatonin onsetDLMO) como marcador potencial de TDM.30 En dicho estudio se planteó que la sensibilidad y la especificidad elevadas del ángulo de fase entre la acrofase del cortisol y el DLMO son útiles para distinguir los pacientes con TDM del grupo control. Las diferencias de ángulo de fase se correlacionaron con la gravedad de la depresión,31,32 en tanto que en adultos jóvenes con trastornos unipolares y bipolares fueron observados ángulos de fase anormales entre el sueño, la melatonina y la temperatura.33 Dichos estudios permiten sugerir que la evaluación del DLMO asociado con los trastornos del estado de ánimo en pacientes con TDM puede ser de utilidad para distinguir los subtipos de TDM. Aún debe evaluarse su relación con la respuesta a la farmacoterapia.
¿Uso de melatonina como antidepresivo?
La información sobre la actividad antidepresiva de la melatonina no es concluyente. Los modelos preclínicos de actividad antidepresivas están lejos de ser unánimes en cuanto a la demostración de los efectos de tipo antidepresivo asociados con la administración de melatonina. En un modelo de estrés crónico leve realizado con ratones se halló cierto indicio de actividad antidepresiva.34-37 Asimismo, la melatonina provocó un efecto de tipo antidepresivo en las pruebas de suspensión por la cola realizadas con ratones38,39 y de nado forzado realizadas con ratas.40 En cambio, otras pruebas preclínicas no indicaron un efecto de tipo antidepresivo ante la administración de melatonina como monodroga. En el modelo de bulbectomía olfatoria, la melatonina fue significativamente menos efectiva que la imipramina o la agomelatina para provocar un efecto sobre la hiperactividad.41 El aumento de la liberación de glutamato en la corteza prefrontal inducido por el estrés no pudo prevenirse mediante la administración crónica de melatonina, a diferencia de lo observado al administrar el agonista melatoninérgico agomelatina.42
En un estudio aleatorizado, a doble ciego y cruzado realizado con seis pacientes con depresión moderada a grave no se halló que la melatonina afecte en forma significativa la sintomatología depresiva.43 De hecho, en cuatro sujetos tuvo lugar una exacerbación notoria de la sintomatología. En cambio, los pacientes con depresión invernal (trastorno afectivo estacional) tratados con melatonina durante tres semanas (0.125 mg) presentaron una mejoría significativa de los síntomas depresivos (disminución > 39%).44 La respuesta fue atribuida a un adelanto de fase circadiana, aunque dicha hipótesis no fue evaluada en forma independiente.
Una tendencia terapéutica actual para el tratamiento de los pacientes con depresión es el uso de moléculas antioxidantes como terapia adyuvante.45 Las propiedades antioxidantes de la melatonina fueron documentadas adecuadamente.46 La combinación de la melatonina (5 a 10 mg/día) con la fluoxetina durante cuatro semanas no mejoró significativamente los síntomas depresivos.47 Mientras que los síntomas depresivos no mejoraron en forma notoria, la calidad subjetiva del sueño aumentó. La administración de una formulación de melatonina de liberación sostenida mejoró un 36% el puntaje inicial del ítem de la escala de Hamilton correspondiente al insomnio al ser combinada con antidepresivos.48 La evaluación de parámetros objetivos (actigrafía de muñeca) y subjetivos (diarios, escalas de evaluación) relacionados con el sueño no indicó un efecto estadísticamente significativo de la melatonina (6 mg/día, liberación lenta) al compararla frente al placebo como complemento del tratamiento antidepresivo preexistente.49
La melatonina no tendría efecto antidepresivo al ser administrada sola. El uso simultáneo de la melatonina junto con otras drogas puede beneficiar ciertos aspectos de los trastornos del sueño en algunos pacientes. Es probable que los pacientes que responden mejor a la administración nocturna de melatonina sean aquellos con un retraso de fase del sueño. Esta hipótesis debe ser evaluada en una población clínica apropiada.
Agomelatina, un antidepresivo melatoninérgico
La agomelatina es una droga que permite reentrenar los ritmos circadianos afectados de un modo dependiente de la dosis.50 En investigaciones adicionales se indicó que probablemente la droga tenga propiedades antidepresivas. A pesar del éxito de la agomelatina, hasta el día de la fecha no se cuenta con nuevos fármacos melatoninérgicos para el tratamiento de los pacientes con depresión. En parte, el efecto de la agomelatina se asocia con su perfil farmacológico. La agomelatina presenta un efecto potente sobre los receptores melatoninérgicos MT1 y MT2 en el ser humano, aunque también se demostró una actividad antagonista adicional sobre los receptores 5HT2C.52 Asimismo, se demostró el antagonismo de los receptores 5HT2B con una potencia equivalente frente a los efectos hallados sobre los receptores 5HT2C. La interacción con más de 50 receptores adicionales y subtipos de receptores no fue considerada significativa desde el punto de vista farmacológico.53 Como consecuencia del antagonismo 5HT2C, la agomelatina incrementa los niveles de dopamina y noradrenalina (pero no los de serotonina) en forma dependiente de la dosis a nivel de la corteza prefrontal, efecto específico sobre dicha región.52 Esta acción antagonista sobre los receptores 5HT2C fue determinante para la actividad antidepresiva de la agomelatina observada en experimentos preclínicos conductuales.
La agomelatina fue activa luego de su administración aguda y subcrónica durante la prueba de nado forzado realizada con ratas y ratones.54 En cambio, la administración de melatonina como monodroga no fue activa en esta prueba. Una actividad similar fue detectada en el modelo de desesperanza aprendida.55 En el modelo de estrés crónico leve, el tratamiento nocturno con agomelatina o melatonina durante cinco semanas revirtió la anhedonia de un modo dependiente de la dosis.35 La melatonina fue menos activa que la agomelatina. En el modelo realizado con ratas con bulbectomía olfatoria, la administración nocturna de agomelatina fue tan activa como la administración de imipramina. La melatonina presentó cierta actividad pero no fue tan activa como la agomelatina, en tanto que el agonista selectivo 5HT2C, denominado S32006, fue menos activo que la agomelatina sola.41 Dicha información indica la necesidad de sinergia entre el agonismo melatoninérgico y el antagonismo 5HT2C para observar efectos de tipo antidepresivos en el modelo. En consecuencia, la visión consensuada es que la combinación del agonismo melatoninérgico y el antagonismo 5HT2C es necesaria para observar la actividad antidepresiva de la agomelatina.
Eficacia clínica de la agomelatina
El programa clínico de estudio de la eficacia antidepresiva de la agomelatina en pacientes con TDM fue evaluado en otra revisión.56 Dicha revisión y la mayoría de otras revisiones independientes de la información coinciden en cuanto a la actividad antidepresiva que presenta la agomelatina.56-60 En la Tabla 2 se incluye un resumen de estudios clínicos publicados. Los estudios incluidos en la base de datos enviada a las autoridades de comercialización no son unánimes acerca de la eficacia antidepresiva. No obstante, esto también tendría lugar en las bases de datos correspondientes a la mayoría de las nuevas moléculas antidepresivas comercializadas y no sería una característica única de la agomelatina. La falta de diferenciación entre una droga y el placebo podría atribuirse a cuestiones metodológicas como el diseño del estudio y la selección de pacientes.
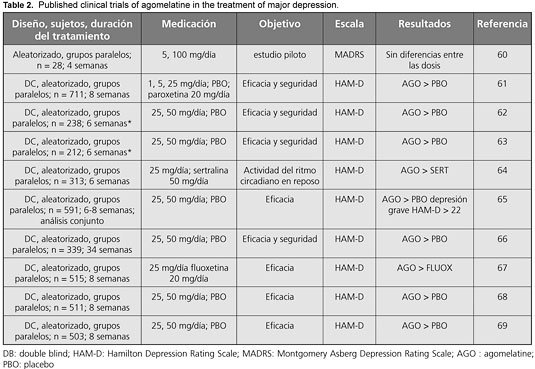
En un metanálisis de estudios a doble ciego y controlados con placebo se concluyó que la agomelatina es un antidepresivo efectivo, superior frente al placebo y similar frente a otras drogas antidepresivas estándar.56 La magnitud de efecto del tratamiento se estimó mediante el cálculo de las diferencias medias estandarizadas por el método de la g de Hedges. El metanálisis incluyó tanto estudios publicados como estudios no publicados. Los índices de respuesta (disminución = 50% del puntaje inicial de la escala de evaluación de la depresión) en comparación con el placebo favorecieron a la agomelatina, con una magnitud de efecto de 0.24 (intervalo de confianza del 95%: 0.12 a 0.35). Este valor es algo inferior en comparación con las magnitudes de efecto correspondientes a las diferencias entre otros antidepresivos y el placebo, que alcanzaron un valor aproximado de 0.31.70 Con respecto a los índices de remisión (puntaje en la Hamilton Depression Rating Scale (HAM-D) < 7 o puntaje en la Montgomery Asberg Depression Rating Scale (MADRS < 12), la agomelatina no fue diferente en comparación con el placebo. No se hallaron diferencias significativas en términos de respuesta o remisión al comparar la agomelatina frente a otros antidepresivos (sertralina, escitalopram, fluoxetina, paroxetina y venlafaxina). Los estudios incluidos en el metanálisis fueron de duración breve (seis a doce semanas). El análisis de la base de datos que incluye estudios sobre las formas graves de depresión reveló que a medida que aumenta la gravedad absoluta de la depresión también aumentan significativamente las diferencias entre las drogas y el placebo.59 Esto confirma los hallazgos obtenidos en metanálisis de otras bases de datos que indican que los antidepresivos funcionan mejor en presencia de formas moderadas a graves del trastorno.71 La prevención de las recaídas fue demostrada ante la administración de agomelatina a un grupo de pacientes que respondieron al tratamiento con 25 o 50 mg durante 8 a 10 semanas y luego fueron asignados a la continuidad del tratamiento con agomelatina o placebo.66 Durante las siguientes 24 semanas, los participantes que recibieron placebo recayeron en mayor medida que los individuos tratados con agomelatina (46.6% versus 21.7%). La agomelatina fue significativamente superior frente al placebo para mantener la respuesta.
La información acumulada permite sugerir que la agomelatina tiene un efecto antidepresivo. Los estudios preclínicos indican que las propiedades de agonismo melatoninérgico y antagonismo 5HT2C contribuyen en forma notoria a esta actividad antidepresiva. Si bien dicho hallazgo no se observó directamente en estudios clínicos, los datos indirectos coinciden con la hipótesis. Aunque la agomelatina tiene efectos equivalentes a la melatonina, bien definidos en cuanto al reentrenamiento de los ritmos circadianos, la melatonina administrada como monodroga no tendría efectos antidepresivos clínicos. Por el otro lado, muchos antidepresivos efectivos presentan propiedades de antagonismo 5HT2C, las cuales deben contribuir a su actividad antidepresiva. En su conjunto, dicha información deductiva preclínica y clínica apoya la existencia de una actividad antidepresiva propia para la agomelatina debida a la acción sinérgica sobre diversos receptores. Más aun, como se señala más adelante, los agonistas melatoninérgicos sin acción sobre los receptores 5HT2C generalmente no mostraron actividad antidepresiva.
Uso de otros agonistas melatoninérgicos como antidepresivos
Si bien existen muchos agonistas melatoninérgicos adicionales disponibles, solo algunos fueron indicados para su uso clínico.72 El ramelteon, autorizado en presencia de insomnio, tiene una afinidad más elevada por los receptores MT1 y MT2 en comparación con la melatonina. La droga no presenta afinidad apreciable por otros neurotransmisores o receptores hormonales.73 Además, no fue usada como monoterapia para el tratamiento de los pacientes con depresión. No obstante, el agregado de una toma nocturna de ramelteon al tratamiento con sertralina en un paciente anciano con TDM resultó en una remisión sostenida de los síntomas durante un período de hasta seis meses.74 Un grupo de pacientes eutímicos con trastorno bipolar y alteraciones del sueño fueron tratados con ramelteon o placebo en combinación con otras drogas. Aquellos tratados con ramelteon tuvieron menos probabilidades de recaer en comparación con aquellos que recibieron placebo.75 Es posible que los efectos del ramelteon sobre el sueño hayan estabilizado a los pacientes con trastorno bipolar.
El tasimelteon, un agonista melatoninérgico con afinidad elevada por los receptores MT1 y MT2, tiene efectos beneficiosos sobre la latencia y el mantenimiento del sueño,76 aunque no existen estudios sobre su uso solo o como complemento del tratamiento de los pacientes con TDM.
La piromelatina (Neu-P11), una droga en fase de investigación, interactúa con los receptores MT1, MT2, 5-HT1A y 5HT1D y aumenta la actividad del GABA mediante un efecto indirecto. En un estudio en fase II, realizado con pacientes con insomnio, se demostró una mejoría significativa del mantenimiento del sueño ante su administración.77 En estudios preclínicos la droga presentó propiedades de tipo antidepresivas y ansiolíticas.78 Son necesarios estudios clínicos para obtener conclusiones sobre el uso potencial del compuesto. De todos modos, el perfil farmacológico y los estudios preclínicos sugieren que la droga sería clínicamente útil. El perfil variado de acciones coincide con el concepto que indica que los efectos de agonismo melatoninérgico aislado resultan insuficientes para lograr una actividad antidepresiva, ansiolítica, o ambas.
Conclusiones
Las mediciones aisladas de las concentraciones plasmáticas de melatonina o de las concentraciones urinarias del metabolito de la melatonina no serían útiles como biomarcadores de depresión mayor. Las concentraciones hormonales pueden ser influidas por factores demográficos y farmacológicos que afectan la interpretación de los hallazgos. No existen fundamentos adecuados que indiquen la existencia de un subtipo de depresión mayor caracterizado por un nivel bajo de melatonina. El muestreo seriado de las concentraciones plasmáticas nocturnas de melatonina tiene utilidad para la identificación de un subgrupo de pacientes que presentan anormalidades del ritmo circadiano. Si bien es probable que no tenga un efecto antidepresivo propio, el entrenamiento del sistema circadiano puede ser de ayuda para la recuperación de los pacientes con episodios de TDM. Por otra parte, existen escasos fundamentos para el uso de melatonina o agonistas melatoninérgicos como monoterapia para los pacientes con TDM. La melatonina (o sus agonistas) puede tener cierta actividad como adyuvante del tratamiento antidepresivo, aunque eso probablemente se limite a la mejoría de los parámetros del sueño.
Los beneficios terapéuticos del agonista de los receptores MT1 y MT2 agomelatina en pacientes con depresión se deben a sus propiedades farmacológicas adicionales. En estudios preclínicos se sugiere que el antagonismo 5HT2C es importante en este sentido. La relevancia clínica de dichos efectos adicionales aún no es clara. No se cuenta con otros ejemplos que permitan evaluar esta hipótesis. Los agonistas melatoninérgicos con propiedades farmacológicas adicionales aguardan su evaluación en modelos preclínicos y estudios clínicos. Queda claro que la evaluación de dichas moléculas es de interés heurístico para definir la utilidad del agonismo melatoninérgico y el requerimiento de acciones farmacológicas adicionales para el tratamiento de los pacientes con depresión.
 Bibliografía del artículo
Bibliografía del artículo
1. Hickie IB, Naismith SL, Robillard R, Scott EM, Hermens DF.Manipulating the sleep-wake cycle and circadian rhythms to improve clinical management of major depression. BMC Medicine 11: 79-106, 2013.
2. Souetre E, Salvati E, Belugou JL, Pringuey D, Candito M, Krebs B, et. al. Circadian rhythms in depression and recovery: evidence for blunted amplitude as the main chronobiological abnormality. Psychiatry Research 28:263-78, 1989.
3. Wirz-Justice A. hronobiology and mood disorders. Dialogues in clinical neuroscience 5: 315-325, 2003.
4. Grandin LD, Alloy LB, Abramson LY. The social zeitgeber theory, circadian rhythms and mood disorders: Review and evaluation. Clinical psychology reviews, 26: 679-694, 2006.
5. Germain A, Kupfer D. Circadian rhythm disturbances in depression. Human Psychopharmacology 23: 571-585, 2008.
6. Norman TR, Dysfunctional circadian rhythms and mood disorders: Opportunities for novel therapeutic approaches, In: JF Cryan and BE Leonard (Eds) Depression: From Psychopathology to Pharmacotherapy, S Krager Basel pp32-52, 2010.
7. Racagni G, Riva M, Popoli M. The interaction between the internal clock and antidepressant efficacy. International Clinical Psychopharmacology (Suppl. 2):S9-S14, 2007.
8. Agez L, Laurent V, Guerrero HY, Pevet P, Masson-Pevet M, Gauer F, Endogenous melatonin provides an effective circadian message to both the suprachiasmatic nuclei and the pars tuberalis of the rat. Journal of Pineal Research 46:95-105, 2009.
9. Jimerson DC, Lynch HJ, Post RM, Wurtman RJ, Bunney WE. Urinary melatonin rhythms during sleep deprivation in depressed patients and normal. Life Sciences 20: 1501-1508, 1977.
10. Tuunainen A, Kripke DF, Elliott JA, Assmusa JD, Rex KM, Klauber MR, et. al. Depression and endogenous melatonin in postmenopausal women.Journal of Affective Disorders 9:149-58, 2002.
11. Crasson M, Kjiri S, Colin A, Kjiri K, Hermite- Baleriaux M, Ansseau M, et. al. Serum melatonin and urinary 6- sulfatoxymelatonin in major depression. Psychoneuroendocrinology 29: 1-12, 2004.
12. Carvalho LA, Gorenstein C, Moreno RA, Markus RP. Melatonin levels in drug-free patients with major depression from the southern hemisphere. Psychoneuroendocrinology 31: 761-768, 2006.
13. Voderholzer U, Laakmann G, Becker U, Haag C, Baghai T, Riemann D, et.al. Circadian profiles of melatonin in melancholic depressed patients and healthy subjects in relation to cortisol secretion and sleep. Psychiatry Research 71: 151-161, 1997.
14. Wetterberg L, Beck-Friis J, Aperia B, Petterson U. Melatonin cortisol ratio in depression. Lancet 2: 1361, 1979.
15. Nair NPV, Hariharasubramanian N, Pilapil C. Cicadian rhythm of plasma melatonin in endogenous depression. Progress in Neuro-Psychopharmacology & Biological Psychiatry 8:715-718, 1984
16. Claustrat B, Chazot G, Brun J, Jordan D, Sassolas G. A chronobiological study of melatonin and cortisol secretion in depressed subjects: plasma melatonin, a biological marker in major depression. Biological Psychiatry 19: 1215-1228, 1984.
17. Brown R, Kocsis JH, Caroff S, Amsterdam J, Winokur A, Stokes PE. Frazer A, Differences in nocturnal melatonin secretion between melancholic depressed patients and control subjects. American Journal of Psychiatry 142:811-816, 1985.
18. McIntyre IM, Judd FK, Norman TR, Burrows GD. Plasma melatonin concentrations in depression. Australian and New Zealand Journal of Psychiatry 20: 381-383, 1986.
19. Frazer, A, Brown, R, Kocsis, J, Caroff, S, Amsterdam, J, Winokur, A, et. al. Patterns of melatonin rhythms in depression. Journal of Neural Transmission 21 (Suppl): 269-290, 1986.
20. Fattah HIA, El-Demerdash OH, Abdel-Sattar NA, Sallam MS, Zakaria MF, El-Ghor MH. Melatonin the hormone of the pineal body: Its role as an endogenous biological marker in major depression and breast cancer. Ain Shams Medical Journal 47:719-731,1996.
21. Fountoulakis KN, Karamouzis M, Iacovides A, Nimatoudis J, Diakogiannis J, Kaprinis J, et. al. Morning and evening plasma melatonin and dexamethasone suppression test in patients with non-seasonal major depressive disorder from northern Greece (Latitude 40-41;5°). Neuropsychobiology 44:113-117, 2001.
22. Meliska CJ, Martínez LF, Lopez AM, Sorenson DL, Nowakowski S, Kripke DF, et.al. Antepartum depression severity is increased during seasonally longer nights: Relationship to melatonin and cortisol timing and quantity. Chronobiology International 30:116-173, 2013.
23. Beck-Friis J, Ljunggren JG, Thorén M, von Rosen D, Kjellman BF, Wetterberg L. Melatonin, cortisol and ACTH in patients with major depressive disorder and healthy humans with special reference to the outcome of the dexamethasone suppression test. Psychoneuroendocrinology 10:173-86, 1985.
24. Mendlewicz J, Branchey L, Weinberg U, Branchey M, Linkowski P, Weitzman ED. The 24-hour pattern of plasma melatonin in depressed patients before and after treatment. Psychopharmacology 4: 49-55, 1980.
25. Rao ML, Muller-Oerlinghausen B, Mackert A, Strebel B, Stieglitz RD, Volz HP, Blood serotonin, serum melatonin and light therapy in healthy subjects and in patients with non-seasonal depression. Acta Psychiatrica Scandinavica 86: 127-132, 1992.
26. Rubin RT, Heist EK, McGeoy SS, Hanada K, Lesser IM, Neuroendocrine Aspects of primary endogenous depression XI. Serum melatonin measures in patients and matched control subjects. Archives of General Psychiatry 49:558-567, 1992.
27. Thompson C, Franey C, Arendt J, Checkley SA, A comparison of melatonin secretion in depressed patients and normal subjects. British Journal of Psychiatry 152: 260-265, 1988.
28. Shafii M, MacMillan DR, Key MP, McCue-Derrick A, Kaufman N, Nahinsky ID. Nocturnal serum melatonin profile in major depression in children and adolescents. Archives of General Psychiatry 53:1009-1013, 1996.
29. Szymanska A, Rabe-Jalonska J, Karasek M, Diurnal profile of melatonin concentrations in patients with major depression: relationship to the clinical manifestation and antidepressant treatment. Neuroendocrinology Letters 22:192-198, 2001.
30. Buckley TM, Schatzberg AF, A pilot study of the phase angle between cortisol and melatonin in major depression - A potential biomarker? Journal of Psychiatric Research 44: 69-74, 2010.
31. Emens J, Lewy A, Kinzie JM, Arntz D, Rough J, Circadian misalignment in major depressive disorder. Psychiatry Research 168: 259-261, 2009.
32. Hasler BP, Buysse DJ, Kupfer DJ, Germain A, Phase relationships between core body temperature, melatonin, and sleep are associated with depression severity: Further evidence for circadian misalignment in non-seasonal depression. Psychiatry Research 178:205-207, 2010.
33. Robillard R, Naismith SL, Rogers NL, Scott EM, Ip TKC, Hermens DF, et. al., Sleep-wake cycle and melatonin rhythms in adolescents and young adults with mood disorders: Comparison of unipolar and bipolar phenotypes. European Psychiatry 28: 412-416, 2013.
34. Kopp C, Vogel E, Rettori MC, Delagrange P, Misslin R, The effects of melatonin on the behavioural disturbances induced by chronic mild stress in C3H/He mice. Behavioural Pharmacology 10, 73-83, 1999.
35. Papp M, Gruca P, Boyer P-A, Mocaer E, Effect of agomelatine in the chronic mild stress model of depression in the rat. Neuropsychopharmacology 28:694-703, 2003.
36. Detanico BC, Piato AL, Freitas JJ, L´hullier FL, Hidalgo MP, Caumo W, Elisabetsky E. Antidepressant-like effects of melatonin in the mouse chronic mild stress model. European Journal of Pharmacology 607:121-125, 2009.
37. Haridas S, Kumar M, Manda K, Melatonin ameliorates chronic mild stress induced behavioural dysfunctions in mice. Physiology and Behaviour 119:201-207, 2013.
38. Prakhie IV, Oxenkrug GF. The effect of nifedipine Ca2 antagonist on activity of MAO inhibitors N-acetyl-serotonin and melatonin in the mouse tail suspension test. International Journal of Neuropsychopharmacology 1:35-45, 1998.
39. Mantovani M, Pértile R, Calixto JB, Santos ARS, Rodrigues ALS. Melatonin exerts an antidepressant-like effect in the tail suspension test in mice: evidence for involvement of N-methyl-D-aspartate receptors and the L-arginine-nitric oxide pathway. Neuroscience Letters 343: 1-34, 2003.
40. Micale V, Arezzi A, Rampello L, Drago F. Melatonin affects the immobility time of rats in the forced swim test: the role of serotonin neurotransmission. European Neuropsychopharmacology 16: 538-545, 2006.
41. Norman, T.R, Cranston, I, Irons, J.A, Gabriel, C, Dekeyne, A, Millan, M.J, et. al. Agomelatine suppresses locomotor hyperactivity in olfactory bulbectomised rats: a comparison to melatonin and to the 5-HT2C antagonist, S32006. European Journal of Pharmacology 674:27-32, 2012.
42. Tardito D, Milanese M, Bonifacino T, Musazzi L, Grilli M, Mallei A, et. al., Blockade of stress-induced increase of glutamate release in the rat prefrontal/frontal cortex by agomelatine involves synergy between melatonergic and 5HT2C receptor-dependent pathways. BMC Neuroscience 11:68-72, 2010.
43. Carman JS, Post RM, Buswell R, Goodwin FK. Negative effects of melatonin on depression. American Journal of Psychiatry 133: 1181-1186, 1976.
44. Lewy AJ, Bauer VK, Cutler NL, Sack RL. Melatonin treatment of winter depression: a pilot study. Psychiatry Research 77:57-61, 1998.
45. Pandya CD, Howell KR, Pillai A. Antioxidants as potential therapeutics for neuropsychiatric disorders. Progress in Neuro-Psychopharmacology & Biological Psychiatry 46:214-223, 2013.
46. Reiter RJ, Tan DX, Manchester LC, El-Sawi MR. Melatonin Reduces Oxidant Damage and Promotes Mitochondrial Respiration: Implications for Aging. Annals of the New York Academy of Sciences 959:238-325, 2002.
47. Dolberg OT, Hirschmann S, Grunhais L. Melatonin for the treatment of sleep disturbances in major depressive disorder. American Journal of Psychiatry 155:1119-1121, 1998.
48. Dalton EJ, Rotondi D, Levitan RD, Kennedy SH, Brown GM. Use of slow release melatonin in treatment resistant depression. Journal of Psychiatry and Neuroscience 25: 48-52, 2000.
49. Serfaty MA, Osborne D, Buszewicz MJ, Blizard R, Raven PW. A randomized double-blind placebo-controlled trial of treatment as usual plus exogenous slow-release melatonin (6 mg) or placebo for sleep disturbance and depressed mood. International Clinical Psychopharmacology 25:132-141, 2010.
50. Redman JR, Guardiola-Lemaître B, Brown M, Delagrange P, Armstrong SM. Dose-dependent effects of S20098, a melatonin agonist on direction of re-entrainment of rat circadian rhythms. Psychopharmacology 118:385-390, 1995.
51. de Bodinat C, Guardiola-Lemaitre B, Mocaër E, Renard P, Muñoz C, Millan MJ. Agomelatine, the first melatonergic antidepressant: discovery, characterization and development. Nature Reviews. Drug Discovery 9:628-642, 2010.
52. Millan MJ, Gobert A, Lejeune F, Dekeyne A, Newman-Tancredi A, Pasteau V, et. al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-Hydroxytryptamine 2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. Journal of Pharmacology and Experimental Therapeutics 306: 954-964, 2003.
53. Chagraoui A, Protais P, Filloux T, Mocaer E. Agomelatine (S20098) antagonises the penile erections induced by the stimulation of 5HT2C receptors in Wistar rats. Psychopharmacology 170:17-22, 2003.
54. Bourin M, Mocaer E, Porsolt R. Antidepressant-like activity of S20098 (agomelatine) in the forced swimming test in rodents: involvement of melatonin and serotonin receptors. Journal of Psychiatry and Neuroscience 29: 126-133, 2004.
55. Bertaina-Anglade V, Drieu C, Boyer PA, Mocaer E. Antidepressant-like effects of agomelatine (S 20098) in the learned helplessness model. Behavioural Pharmacology 17:703-713, 2006.
56. Taylor D, Sparshatt A, Varma S, Olofinjana O. Antidepressant efficacy of agomelatine: meta-analysis of published and unpublished studies. British Medical Journal 348:g1888, 2014.
57. Howland RH. Agomelatine: a novel atypical antidepressant. Journal of Psychosocial Nursing and Mental Health Services 45:13-17, 2007.
58. Kennedy SH. Agomelatine: efficacy at each phase of antidepressant treatment. CNS Drugs 23 (Suppl. 2):41-47, 2009.
59. Kennedy SH, Rivzi SJ. Agomelatine in the treatment of major depressive disorder: potential for clinical effectiveness. CNS Drugs 24: 479-499, 2010.
60. Singh SP, Singh V, Kar N. Efficacy of agomelatine in major depressive disorder: meta-analysis and appraisal. International Journal of Neuropsychopharmacology 15:417-428, 2012.
61. Loo H, Dalery J, Macher JP, Payen A. Pilot study comparing in blind the therapeutic effect of two doses of agomelatine, melatonin- agonist and selective 5HT2c receptors antagonist, in the treatment of major depressive disorders. L´Encephale 29: 165-171, 2002.
62. Loo H, Hale A, D´haenen H. Determination of the dose of agomelatine, a melatoninergic agonist and selective 5-HT(2C) antagonist, in the treatment of major depressive disorder: a placebo-controlled dose range study. International Clinical Psychopharmacology 17:239-247, 2002.
62. Olie JP, Kasper S. Efficacy of agomelatine, a MT1/MT2 receptor agonist with 5-HT2C antagonistic properties, in major depressive disorder. International Journal of Neuropsychopharmacology 10:661-673, 2007.
63. Kennedy SH, Emsley R. Placebo-controlled trial of agomelatine in the treatment of major depressive disorder. European Neuropsychopharmacology ; 16:93-100, 2006.
64. Kasper S, Hajak G, Wulff K, Hoogendijk WJG, Montejo AL, Smeraldi E, et. al. Efficacy of the novel antidepressant agomelatine on the circadian rest-activity cycle and depressive and anxiety symptoms in patients with major depressive disorder a randomized, double-blind comparison with sertraline. Journal of Clinical Psychiatry 71:109-120, 2010.
65. Montgomery SA, Kasper S. Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatine. International Clinical Psychopharmacology 22:283-291, 2007.
66. Goodwin GM, Emsley R, Rembry S, Rouillon F. Agomelatine prevents relapse in patients with major depressive disorder without evidence of a discontinuation syndrome: a 24-week randomized, double-blind, placebo-controlled trial. Journal of Clinical Psychiatry 70:1128-1137, 2009.
67. Hale A, Corral R-M, Mencacci C, Ruiz JS, Severo CA, Gentil V. Superior antidepressant efficacy results of agomelatine vs. fluoxetine in severe MDD patients: a randomized, double-blind study. International Clinical Psychopharmacology 25:305-314, 2010.
68. Zajecka J, Schatzberg A, Stahl S, Shah A, Caputo A, Post A. Efficacy and safety of agomelatine in the treatment of major depressive disorder: a multicenter, randomized, double-blind, placebo-controlled trial. Journal of Clinical Psychopharmacology 30:135-144, 2010.
69. Stahl SM, Fava M, Trivedi MH, Caputo A, Shah A, Post A. Agomelatine in the treatment of major depressive disorder: an 8-week, multicentre, randomised, placebo controlled trial. Journal of Clinical Psychiatry 71:616-626, 2010.
70. Turner EH, Matthews AM, Linardatos E, Tell RA, Rosenthal R. Selective publication of antidepressant trials and its influence on apparent efficacy. N Engl J Med 358:252-260, 2008.
71. Kirsch I, Deacon BJ, Huedo-Medina TB, Scoboria A, Moore TJ, Johnson BT. Initial severity and antidepressant benefits: a meta-analysis of data submitted to the Food and Drug Administration. PLoS Med 5: e45, 2008.
72. Carocci A, Catalano A, Sinicropi MS. Melatonergic drugs in development. Clinical Pharmacology: Advances and Applications 6:127-137, 2014.
73. McGechan A, Wellington K, Ramelteon. CNS Drugs 19: 1057-1065, 2005.
74. Furuya F, Kunishige K, Miyaoka T, Wake R, Liaury K, Sadakuni F, Horiguchi J. Augmentation with ramelteon to achieve remission in geriatric major depression. Psychiatry and Clinical Neurosciences 66: 80-83, 2012.
75. Norris ER, Burke K, Correll JR, Zemanek KJ, Lerman J, Primelo RA, et.al. A double-blind, randomized, placebo-controlled trial of adjunctive ramelteon for the treatment of insomnia and mood stability in patients with euthymic bipolar disorder. Journal of Affective Disorders144:141-147, 2013.
76. Rajaratnam SM, Polymeropoulos MH, Fisher DM, Roth T, Scott C, Birznieks G, et.al. Melatonin agonist tasimelteon (VEC-162) for transient insomnia after sleep-time shift: Two randomised controlled multicentre trials. Lancet 373:482-491, 2009.
77. Laudon M, Nir T, Zisapel N. Development of piromelatine, a novel multimodal sleep medicine. European Neuropsychopharmacology S145, 2014.
78. Tian S-W, Laudon M, Han L, Gao J, Huang F, Yang Y, et.al. Antidepressant- and anxiolytic effects of the novel melatonin agonist Neu-P11 in rodent models. Acta Pharmacologica Sinica 31:775-783, 2010.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



