|
Coautores
Manuel Galán-Gutierrez* Daniel Sánchez-Cano**
Médico, Complejo Hospitalario de Jaén, Jaén, España*
Médico, Hospital Santa Ana, Motril, España**
|
|
Recepción del artículo: 26 de septiembre, 2014
|
|
Aprobación: 8 de noviembre, 2014
|
 Conclusión breve
Conclusión breve
La utilización de etanercept en la psoriasis ha hecho que, poco a poco, empiecen a surgir cuestiones sobre su tratamiento en situaciones especiales que requieren tener en cuenta las particularidades de su aplicación (lactancia, vacunaciones, infecciones).
 Resumen
Resumen
La psoriasis es una enfermedad crónica, inflamatoria, mediada inmunológicamente, con una considerable repercusión en la calidad de vida de los pacientes. Su importancia además viene dada, entre otros factores, por su elevada prevalencia en la población. Los avances en el conocimiento de la inmunopatología de esta enfermedad y de la biología molecular han permitido el desarrollo de nuevos fármacos que representan una nueva forma de abordar la situación de estos pacientes, y que se encuadran en la denominada terapia biológica. El etanercept se empleó por primera vez en estudios clínicos con seres humanos en 1992 y ya son varios cientos de miles los enfermos tratados en todo el mundo por diferentes patologías. Actualmente, la Agencia Europea de Evaluación de Medicamentos (EMEA) tiene aprobada la indicación de etanercept en las siguientes patologías: 1. Psoriasis en placa en adultos ("adultos con psoriasis en placa, de moderada a grave, que no han respondido o que tienen contraindicada, o no toleran, otra terapia sistémica incluyendo ciclosporina, metotrexato o PUVA"); 2. Psoriasis pediátrica grave en placa. 3. Artritis psoriásica; 4. Artritis reumatoidea; 5. Artritis idiopática juvenil poliarticular; 6. Espondilitis anquilosante. Su utilización en la psoriasis, ya bien conocida, ha hecho que poco a poco empiecen a surgir cuestiones sobre su manejo en situaciones especiales que requieren tener en cuenta las particularidades de su aplicación (lactancia, vacunaciones, infecciones) que abordaremos en este manuscrito.
 Palabras clave
Palabras clave
etanercept, psoriasis, terapia biológica, tuberculosis
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/128781
Especialidades
 Principal: Dermatología, Inmunología,
Principal: Dermatología, Inmunología,
 Relacionadas: Farmacología, Infectología, Obstetricia y Ginecología,
Relacionadas: Farmacología, Infectología, Obstetricia y Ginecología,
 Enviar correspondencia a:
Enviar correspondencia a:
Ricardo Ruiz Villaverde, Complejo Hospitalario de Jaen, 23007, Jaen, España
Results from the use of etanercept in psoriatic patients
 Abstract
Abstract
Psoriasis is a chronic, inflammatory, immune-mediated disease with a considerable impact on quality of life. Its importance is also increased by its high prevalence in the population. Improved understanding of the immunopathology of this disease alongside advances in molecular biology have led to the development of new drugs, collectively referred to as biologic therapy, which offer a novel approach to the management of psoriasis. Etanercept was used for the first time in clinical trials in 1992, and since then, hundreds of thousands patients with a variety of diseases have been treated with the drug worldwide. To date, the European Medicines Agency (EMA) has approved etanercept for use in the following indications: 1. Plaque psoriasis in adults with moderate to severe disease who failed to respond to, have a contraindication for, or are intolerant of other systemic therapy including cyclosporine, methotrexate, or psoralen plus UV-A (PUVA); 2. Severe pediatric plaque psoriasis; 3. Psoriatic arthritis; 4. Rheumatoid arthritis; 5. Polyarticular juvenile idiopathic arthritis; 6. Ankylosing spondylitis. Even though well known, its use in psoriasis has given rise to questions with regard to its management in particularly special settings, such as pregnancy, breastfeeding period, solid and hematological neoplasm, concurrent infections and vaccination.
 Key words
Key words
etanercept, psoriasis, biological therapy, tuberculosis
RESULTADOS DEL USO DE ETANERCEPT EN PACIENTES CON PSORIASIS
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
El etanercept es una proteína de fusión humana que se empleó por primera vez en estudios clínicos con seres humanos en 1992 y ya son varios cientos de miles los enfermos tratados en todo el mundo por diferentes patologías. En 2004 fue aprobado por la Agencia Europea de Evaluación de Medicamentos (EMEA) para el tratamiento de la psoriasis en placas moderada a grave, inicialmente en terapia intermitente, aunque desde septiembre de 2009 está aprobado también para el tratamiento continuo. En diciembre de 2008 (febrero de 2009 en España) se incluyó la aprobación para su empleo en el tratamiento de la psoriasis en placas grave en niños a partir de los 8 años.
A través de un considerable número de estudios, el etanercept ha demostrado una marcada eficacia y seguridad en el tratamiento de la psoriasis y la artritis psoriásica, aportando una nueva y prometedora opción terapéutica.
No obstante, existen contraindicaciones absolutas para su uso: hipersensibilidad al principio activo o a alguno de sus excipientes; sepsis o riesgo de sepsis; pacientes que presenten infecciones activas, incluyendo infecciones crónicas y localizadas; insuficiencia cardíaca de grado III-IV de la New York Heart Association (NYHA), y enfermedad desmielinizante.
Su utilización en la psoriasis, ya bien conocida, ha hecho que poco a poco empiecen a surgir cuestiones sobre su manejo en situaciones especiales que requieren tener en cuenta las particularidades de su aplicación y que pasamos a desarrollar a continuación.
Embarazo y lactancia
El embarazo es una condición especial en la que la terapia utilizada para el control de la psoriasis se encuentra limitada por su posible teratogenicidad. Al no ser una población diana en los ensayos clínicos habituales, es imposible disponer de grandes estudios prospectivos de enfermas psoriásicas embarazadas que ofrezcan una correcta evidencia científica sobre la inocuidad de cualquier medicación empleada durante ese período. En la actualidad, la mayoría de los autores consideran de elección el tratamiento con radiación ultravioleta B (UVB) y, como segunda elección, la ciclosporina A, por su uso en pacientes receptoras de trasplantes. Por el contrario, el uso de retinoides, metotrexato o micofenolato, de teratotoxicidad o embriotoxicidad demostrada, está formalmente contraindicado.1
En relación con el etanercept y su potencial uso en el embarazo, debemos remitirnos a la ficha técnica. En ella se explicita que el etanercept no presentó actividad mutagénica en los ensayos in vitro e in vivo. De acuerdo con esta directriz se incluye en la categoría B de la Food and Drug Administration (FDA), lo cual significa que no ha mostrado su teratogenicidad en la experimentación con animales.
Para valorar el empleo de cualquier medicación en el embarazo debemos tener en cuenta tres situaciones clínicas potenciales:2 a) El uso en mujeres y varones que deseen futura descendencia, considerando la vida media del fármaco y la fisiología del ciclo menstrual en la mujer se aconseja suspender la administración de etanercept un mes antes de planificar la concepción. b) Las pacientes que quedan embarazadas durante la administración del fármaco. Existen pocos casos publicados en la literatura al respecto. Aunque el etanercept no es una inmunoglobulina, su estructura compartida con éstas hace que su paso transplacentario durante el primer trimestre sea muy limitado, pero no así en el segundo y el tercero. En la base de datos reumatológica española BIOBADASER se registraron cinco enfermas con seguimiento adecuado tratadas con etanercept durante el primer trimestre del embarazo, de las que tres tuvieron embarazos sin complicaciones y dos optaron por la terminación electiva.3 c) Finalmente, sería necesario considerar si el medicamento es seguro para ser indicado en el control de la psoriasis moderada o grave en las embarazadas. Si bien la exposición al etanercept durante la concepción no parece que presente riesgos añadidos a los de la propia enfermedad, su posible indicación como alternativa de tratamiento durante todo el embarazo requiere un estudio con mayor detalle. La revisión de las notificaciones realizadas a la FDA de malformaciones congénitas producidas en pacientes a las que se les administraba inhibidores del factor de necrosis tumoral (TNF) han encontrado un porcentaje significativo de anomalías congénitas del espectro VACTERL (múltiples defectos, vértebras, ano, corazón, región traqueoesofágica, riñón y extremidades inferiores). No obstante, la metodología de recogida de datos por declaración voluntaria de cada caso es un sesgo muy importante en la valoración real de los resultados comunicados.
En síntesis, y en relación con el embarazo, el empleo de etanercept no está recomendado en las embarazadas. Es preciso advertir a las mujeres en edad fértil que no deben quedar embarazadas durante la terapia con esta medicación.
Respecto de la lactancia, se desconoce si el etanercept se excreta en la leche materna.4 Sin embargo, debido a que las inmunoglobulinas pueden ser excretadas en la leche materna es de suponer que se elimine por esta vía. Dado que no se conoce el posible efecto del etanercept en el sistema inmunitario inmaduro, y considerando el margen de seguridad actual de la lactancia artificial, no estaría justificado exponer a un neonato al etanercept en caso de que se decidiera este tratamiento en una madre lactante.
Vacunaciones
Uno de los ítems que quizá hemos descuidado los dermatólogos desde la aparición de los fármacos biológicos en el arsenal terapéutico de la psoriasis es el calendario de vacunación recomendado a los pacientes que se van a someter a esta terapia. Es probable, que sea uno más de los lapsus heredados del manejo de la terapia sistémica, pero que en los últimos tiempos está adquiriendo más auge.
En cuanto al tipo de vacunas recomendado para los pacientes con psoriasis en tratamiento biológico, una reciente revisión de la National Psoriasis Foundation estadounidense compara el riesgo de infección del paciente tratado con medicamentos biológicos con el de los individuos sometidos a trasplante que reciben tratamiento inmunosupresor. Así, y siguiendo las directrices de vacunación para los pacientes receptores de trasplante, establece la recomendación de vacunación antigripal anual junto con la vacunación estándar del calendario del adulto para todos aquellos que reciben tratamiento con anti-TNF, entre ellos el etanercept.5
De acuerdo con los calendarios de vacunación actualmente vigentes y con las guías estadounidenses, las recomendaciones de vacunación para un paciente con psoriasis candidato a tratamiento biológico, anti-TNF o antiinterleuquina 12/23 y sin otros factores de riesgo de infección consisten en la administración de vacuna antigripal anual, vacuna antineumocócica de 23 polisacáridos y recuerdo de toxoide antitetánico cada diez años. Debido a la interferencia potencial de los anti-TNF y los anti-interleuquina 12/23 en puntos clave de la cascada inmunológica que actúa frente a las diferentes infecciones potenciales, la administración de vacunas con agentes vivos atenuados está absolutamente contraindicada durante el tratamiento biológico6 (Tabla 1).

Últimamente se halla en debate la inmunización frente a la hepatitis B. En este sentido, serán candidatos iniciales a la vacunación contra el virus de la hepatitis B (VHB) los pacientes que no hayan tenido contacto previo con el virus ni hayan sido vacunados (antígeno HBs, anticuerpos anti-HBc y anti-HBs negativos) y en los que concurra alguno de los factores de riesgo. Finalmente, y desde un punto de vista práctico, teniendo en cuenta que no hay pautas claramente establecidas, se debería esperar entre dos y cuatro semanas tras la inmunización para comenzar el tratamiento biológico.7 La administración de vacunas en pacientes en los que la terapia biológica se encuentra ya instaurada dependerá de si se trata de vacunas con agentes inactivados, en cuyo caso no se requerirá la suspensión del agente biológico, o de vacunas con virus vivos atenuados, en cuyo caso y si bien por ficha técnica no hay una recomendación estricta, deberemos apoyarnos en la semivida media del fármaco, aconsejando suspenderla 2 semividas previas y 5 posteriores.
Cirugía
En determinadas ocasiones el paciente que recibe terapia biológica debe someterse a cirugía programada o a cirugías de urgencia. De acuerdo con la ficha técnica del medicamento, no hay recomendaciones especiales sobre cuándo suspender la administración del etanercept, por lo que una vez más, y de la misma manera que se realiza con el resto de agentes biológicos, se procederá a sus suspensión en virtud de la semivida del fármaco.
Cirugía programada
Si es una cirugía limpia se recomienda la suspensión de 2 a 4 semividas antes de la intervención, mientras que si no lo es, se recomienda ampliar a 5 semividas el período mínimo de suspensión. La reanudación del tratamiento se realiza después de la cicatrización completa y en ausencia de infección.
Cirugía de urgencia
En estos casos se suspenderá el tratamiento con etanercept, valorando la profilaxis antibiótica más adecuada según el tipo de cirugía al que se someta al paciente. Una vez más se procederá a la reanudación del tratamiento cuando se haya producido una cicatrización completa y en ausencia de infección.
Infección crónica por el virus de la inmunodeficiencia humana
En la psoriasis moderada a grave, la primera opción terapéutica recomendada para los individuos infectados por el virus de la inmunodeficiencia humana (VIH) es la fototerapia (UVB o ultravioleta A asociado con psoralenos) y la terapia antiviral pautada por un infectólogo según los parámetros clínicos y serológicos del paciente, puesto que la primera no modifica la carga viral ni el número de linfocitos CD4+ y la segunda se ha relacionado con una mejoría de la clínica cutánea, probablemente en relación con la disminución del TNF-alfa que produce.
En los casos en los cuales no se observe respuesta terapéutica con fármacos antirretrovirales y fototerapia se optará por el tratamiento sistémico. En primer lugar debe considerarse la administración de acitretina (dado que carece de efecto inmunosupresor) y, posteriormente, inmunomoduladores como ciclosporina, metotrexato y los inhibidores del TNF-alfa. En detrimento de la fototerapia y de la acitretina se debe mencionar su nula actuación sobre el componente articular que acompaña a muchos pacientes con psoriasis, especialmente en la población con infección crónica por VIH.
Por lo que se refiere al etanercept, se dispone de pocos datos acerca de su efectividad y seguridad en personas infectadas crónicamente por el VIH. Los casos aislados con buena respuesta incluyen los referidos por Wallis,8 Aboulafia,9 que presenta una artritis psoriásica no controlable con hidroxicloroquina, minociclina, sulfasalazina y corticoides orales y que respondió de forma muy notable a la administración de 25 mg de etanercept dos veces por semana durante seis semanas. Linardaki10 comunica un caso con seguimiento a dos años y sin efectos adversos; Mikhail11 aporta un caso de psoriasis pustulosa de Von Zumbusch con artropatía en un sujeto infectado por el VIH que respondió al tratamiento con 50 mg de etanercept a la semana.
El etanercept parece tener un mecanismo de acción más “fisiológico” que otros anti-TNF, puesto que se une de forma rápida y reversible al TNF, de manera similar a lo que ocurre en el caso del receptor soluble p75. La asociación y la disociación entre etanercept y TNF-alfa tiene lugar de forma muy rápida, y el TNF disociado sigue manteniendo su bioactividad. En cuanto a la farmacocinética de los anti-TNF, es importante recordar que el etanercept es el agente biológico bloqueante de TNF con la semivida más corta, lo cual permite que el manejo del paciente en tratamiento con etanercept sea más eficiente, ya que puede ser suspendido, y se pierde rápidamente su efecto en caso de presentarse un efecto adverso o un cuadro que obligue a recuperar de forma rápida la homeostasis del TNF y la respuesta inmunitaria.12
Infección crónica por los virus de la hepatitis C y B
Los ensayos clínicos con agentes anti-TNF-alfa que se realizaron inicialmente excluyeron los pacientes con hepatitis víricas debido al riesgo potencial que suponía su uso. No obstante, han aparecido publicaciones donde puede deducirse que en el caso de las infecciones crónicas por VHC el uso de los anti- TNF-alfa no tan sólo parece seguro, sino incluso beneficioso. Por el contrario, en las hepatitis crónicas por VHB estos agentes pueden incrementar el riesgo de reactivación de la infección, aunque esta supuesta evidencia no significa que en, determinadas condiciones y con la praxis adecuada, no puedan emplearse agentes anti-TNF-alfa, incluso en el caso de hepatitis crónica por VHB.13
Hepatitis C
La mayor parte de la experiencia acumulada en cuanto a la seguridad del uso de etanercept y otros agentes anti-TNF-alfa en el contexto de la infección por el VHC proviene de enfermos reumatológicos. No obstante, también hay algunos trabajos con pacientes con psoriasis, aunque en este caso a menudo se trata de un número muy limitado de enfermos. Rokhsar,14 De Simone,15 Magliocco y Gottlieb16 han publicado los casos de uno, dos y tres pacientes respectivamente tratados con etanercept en el contexto de la psoriasis asociada con el VHC. Los tres autores acaban comentando que con una correcta monitorización de la carga viral y las enzimas hepáticas, el tratamiento con etanercept es una alternativa adecuada para estos pacientes.17
Hepatitis B
A diferencia de lo comentado en las infecciones por el VHC, en el caso de la hepatitis crónica por el VHB, el TNF-alfa parece desempeñar un importante papel en la supresión de la replicación vírica, y el uso de agentes bloqueadores de esta citoquina teóricamente puede condicionar una activación del VHB y, por lo tanto, un empeoramiento de la enfermedad hepática.
Carroll y Bond18 sugieren que el riesgo de reactivación del VHB es menor con etanercept que con infliximab, probablemente por las diferencias farmacológicas y bioquímicas existentes entre ambos agentes.
La lamivudina es un inhibidor de la transcriptasa inversa que se ha empleado con éxito en la prevención de la reactivación del VHB, que puede suceder de forma secundaria a tratamientos en receptores de trasplante o en linfomas u otros procesos malignos, y que se está empleando también en el manejo de pacientes con psoriasis tratados con terapia biológica y VHB. El tratamiento antiviral para el VHB debería iniciarse de dos a cuatro semanas antes de la administración de cualquier agente inmunosupresor y debe prolongarse hasta tres a seis meses después de la eventual retirada del agente anti-TNF-alfa. El uso de lamivudina a muy largo plazo puede condicionar mutaciones del VHB que conlleven una resistencia al fármaco. En estos casos puede tener lugar un agravamiento de la hepatitis que requerirá fármacos alternativos como el adefovir. Por este motivo, algunos autores recomiendan el uso de lamivudina sólo en pacientes con HBsAg positivo, ya que existen publicaciones de pacientes con HBsAg negativo que no presentan problemas con el tratamiento anti-TNF-alfa a largo plazo.19
Neoplasias
El etanercept presenta un buen perfil de seguridad, pero en la literatura se han descrito múltiples casos clínicos de pacientes que han desarrollado diversas neoplasias durante su uso.20 Entre las enfermedades malignas descritas se destacan las leucemias, ciertos tipos de linfomas y algunos tumores sólidos. Creemos importante destacar que el uso de las terapias biológicas en otras patologías tales como la artritis reumatoidea y la enfermedad de Crohn no son extrapolables a la psoriasis. El paciente afectado por enfermedad de Crohn o con artritis reumatoidea presenta un perfil inflamatorio mucho más elevado. Son sujetos que reciben a lo largo de su vida una mayor cantidad de fármacos inmunosupresores y ello condiciona que en estas patologías el riesgo de aparición de neoplasias esté incrementado.21-26
Tuberculosis. Infección latente tuberculosa
En España, la tuberculosis es una enfermedad de declaración obligatoria a través de la Red Nacional de Vigilancia Epidemiológica. Su incidencia se estima en 18.21 casos/100 000 habitantes en 2007, con una distribución por Comunidades Autónomas no homogénea, sin olvidar que hasta un 30% de los casos podrían no ser declarados.27
Los fármacos anti-TNF-alfa, entre ellos el etanercept, incrementan el riesgo de tuberculosis. El riesgo de reactivación depende de dos variables en nuestros pacientes: el efecto inmunomodulador del tratamiento y la tasa de tuberculosis latente de la población.28,29
El cribado de la infección latente tuberculosa (ILT) y su tratamiento previo al inicio de la terapia son los pilares fundamentales para disminuir su incidencia en los pacientes con psoriasis, disminuyendo hasta un 78% a 85% los casos de tuberculosis si se realiza de forma apropiada. Aunque para el diagnóstico de la ILT se carece de una prueba de referencia, actualmente se dispone de dos tipos de pruebas, como la realización de la prueba tuberculínica (PT) y la determinación in vitro de la producción de interferón (IFN) gamma.30
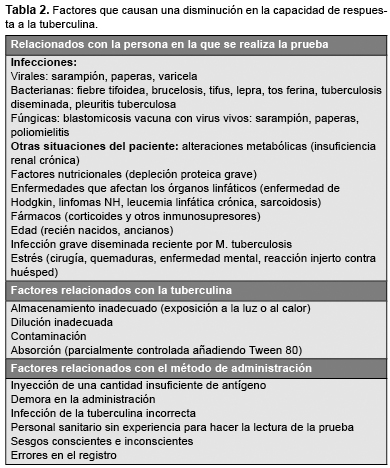
La PT pone de manifiesto una reacción de hipersensibilidad retrasada tipo IV frente a Mycobacterium tuberculosis. Su principal inconveniente es la falta de especificidad, la pérdida de sensibilidad en sujetos inmunodeprimidos y personas recientemente infectadas, y que no es útil para discriminar entre las personas infectadas, las que van a desarrollar enfermedad tuberculosa de las que no lo harán. Es obligatoria la repetición de la PT a los 7 a 10 días si ésta es negativa (efecto booster). Es importante recordar que la realización repetida de la PT no induce sensibilidad tuberculínica. Los factores que causan una disminución en la capacidad de respuesta a la tuberculina se reflejan en la Tabla 2.
Las nuevas técnicas de determinación in vitro de la producción de INF-gamma se basan en la detección de la liberación de INF-gamma por linfocitos T sensibilizados frente a distintos antígenos específicos (ESAT-6, CFP-10 y TB7.7) localizados en la región genómica RD1 del complejo Mycobacterium tuberculosis, pero ausentes en el BCG y otras micobacterias no tuberculosas, con excepción de M. kansaii, M. marinum y M. szulfai. Esta característica permite discriminar entre individuos infectados y vacunados o expuestos a otras micobacterias. En comparación con la tuberculina presenta mayor especificidad pero igual sensibilidad. No obstante, tiene un costo mayor, se ha detectado variabilidad al repetir la prueba y se necesita un laboratorio equipado con personal entrenado. Existen varios métodos de detección de INF-gamma (quantiferon in tube gold y T-SPOT) que difieren en la técnica (ELISA frente a ELISPOT) y en la población celular objeto de la medición (sangre total frente a células mononucleares sanguíneas).
El tratamiento de elección de la ILT es isoniacida durante nueve meses. Otras alternativas son: rifampicina e isoniacida durante tres meses con eficacia similar y mejor cumplimiento; rifampicina por 4 meses; rifampicina y pirazinamida por dos meses, inicialmente no recomendada por el aumento de los efectos secundarios a nivel hepático.
Debe realizarse el seguimiento clínico hasta la finalización del tratamiento y la vigilancia de probables efectos secundarios, se destaca la hepatotoxicidad con controles analíticos previos al tratamiento, al mes y luego según el riesgo, que puede estar incrementado en los pacientes que reciben anti-TNF-alfa, debido a que un porcentaje elevado ya ha recibido tratamiento con otros fármacos hepatotóxicos como el metotrexato. El tratamiento de la ILT se suele iniciar entre uno y dos meses previos al tratamiento con anti-TNF-alfa, aunque lo ideal sería hacerlo tras la finalización de la terapia de ILT. No se debe olvidar que, a pesar del cribado y tratamiento de ILT, pueden presentarse casos de tuberculosis activa, con un mayor porcentaje de cuadros atípicos y diseminados. En estos pacientes podrían estar indicados tratamientos de mayor duración o regímenes periódicos.31-33
 Bibliografía del artículo
Bibliografía del artículo
1. Borrego L. Etanercept en el embarazo y lactancia. Actas Dermosifiliogr 101(Supl. 1):97-101, 2010.
2. Weatherhead S, Robson SC, Reynolds NJ. Management of psoriasis in pregnancy. BMJ 334:1218-20, 2007.
3. Joven BE, García-González AJ, Ruiz T, Moreno E, Cebrián L, Valero M. Pregnancy in women receiving anti-TNF therapy. Experience in Spain. Arthritis Rheum 9:S349, 2005.
4. Otermin I, Elizondo G, Zabaleta J, Amigot A. Etanercept y embarazo. An Sist Sanit Navar 30:491-3, 2007.
5. Lebwohl M, Bagel J, Gelfand JM, Gladman D, Gordon KB, Hsu S, et al. From the medical board of the national psoriasis foundation: monitoring and vaccinations in patients treated with biologics for psoriasis. J Am Acad Dermatol 58(1):94-105, 2008.
6. Puig L, Carrascosa JM, Daudén E, Sánchez-Carazo JL, Ferrándiz C, Sánchez-Regaña M, et al. Directrices españolas basadas en la evidencia para el tratamiento de la psoriasis moderada a grave con agentes biológicos. Actas Dermosifiliogr 100(05):386-413, 2009.
7. Moreno Ramírez D, Domínguez Castellano A. Vacunación del paciente con psoriasis en tratamiento biológico. Piel 26:25-30, 2011.
8. Wallis RS, Kyambadde P, Johnson JL, Horter L, Kittle R, Pohle M, et al. A study of the safety, immunology, virology, and microbiology of adjunctive etanercept in HIV-1-associated tuberculosis. AIDS 18:257-64, 2004.
9. Aboulafia DM, Bundow D, Wilske K, Ochs UI. Etanercept for the treatment of human immunodeficiency virus-associated psoriatic arthritis. Mayo Clin Proc 75:1093-8, 2000.
10. Linardaki G, Katsarou O, Ioannidou P, Karafoulidou A, Boki K. Effective etanercept treatment for psoriatic arthritis complicating concomitant human immunodeficiency virus and hepatitis C virus infection. J Rheumatol 34:1353-5, 2007.
11. Mikhail M, Weinberg JM, Smith BL. Successful treatment with etanercept of von Zumbusch pustular psoriasis in a patient with human immunodeficiency virus. Arch Dermatol 144:453-6, 2008.
12. Barco D, Puig L, Alomar A. Tratamiento de la psoriasis moderada-grave con etanercept en pacientes con infección crónica por el virus de la inmunodeficiencia humana. Actas Dermosifiliogr 101(Supl. 1):77-81, 2010.
13. Bordas X, Martín Sala S. Etanercept e infección crónica por los virus de la hepatitis C y B. Actas Dermosifiliogr 101(Supl. 1):82-87, 2010.
14. Rokhsar C, Rabhan N, Cohen SR. Etanercept monotherapy for a patient with psoriasis, psoriatic arthritis, and concomitant hepatitis C infection. J Am Acad Derm 54:361-2, 2006.
15. De Simone C, Paradisi A, Capizzi R, Carbone A, Siciliano M, Amerio PL. Etanercept therapy in two patients with psoriasis and concomitant hepatitis C. J Am Acad Dermatol 54:1102-4, 2006.
16. Magliocco MA, Gottlieb AB. Etanercept therapy for patients with psoriatic arthritis and concurrent hepatitis C virus infection: report of 3 cases. J Am Acad Derm 51:580-4, 2004.
17. Parke FA, Reveille JD. Anti-tumor necrosis factor agents for rheumatoid arthritis in the setting of chronic hepatitis C infection. Arthritis Rheum 51:800-4, 2004.
18. Carroll MB, Forgione MA. Use of tumor necrosis factor alpha inhibitors in hepatitis B surface antigen-positive patients: a literature review and potential mechanisms of action. Clin Rheumatol 29:1021-9, 2010.
19. Raftery G, Griffiths B, Kay L, Kane D. Chronic viral hepatitis and TNF alpha blockade. Rheumatology (Oxford) 46:1381-2, 2007.
20. García Rabasco A, Sánchez Carazo JL, Esteve A. Etanercept y neoplasias. Actas Dermosifiliogr 101(Supl. 1):88-96, 2010.
21. Gelfand JM, Berlín J, Van Voorhees A, Margolis DJ. Lymphoma rates are low but increased in patients with psoriasis. Arch Dermatol 139:1425-9, 2003.
22. Friedberg J, Jacobsen E, Neuberg D, Kutok J, Muñoz O, Boussiotis V, et al. Targeting the follicular lymphoma microenviroment through blockade of TNF alfa with etanercept. Leuk Lymphoma 49:902-9, 2008.
23. Bakland G, Nossent H. Acute myelogenous leukaemia following etanercept therapy. Rheumatology (Oxford) 42:900-1, 2003.
24. Meyboom RHB, Star K, Bate J. Edwards IR. TNF-a inhibitors and leukaemia: International Pharmacovigilance Reports. Drug Safety 31:445-7, 2008.
25. Klareskog L, Moreland L, Cohen S, et al. Global safety and efficacy of up to five years of etanercept (Enbrel) therapy. Arthritis Rheum 44:S77, 2001.
26. Fulchiero GJ, Salvaggio H, Drabick JJ, Staveley-O´Carroll K, Billingsley EM, Marks JG, et al. Eruptive latent metastatic melanomas after initiation of antitumor necrosis factor therapies. J Am Acad Dermatol 56:S65-7, 2007.
27. Rodríguez E, Hernández G, Díaz O, Tello O. Casos de tuberculosis declarados a la Red Nacional de Vigilancia Epidemiológica. España, 2007. Boletín Epidemiológico Semanal 16:229-40, 2008.
28. González-Sixto B, Rodríguez-Prieto MA. Etanercept e infección latente tuberculosa. Actas Dermosifiliogr 101(Supl. 1):62-69, 2010.
29. Wallis RS, Broder MS, Wong JY, Hanson ME, Beenhouwer DO. Granulomatous infectious due to tumor necrosis factor blockage: correction. Clin Infect Dis 39:1254-6, 2004.
30. Puig L, Bordas X, Carrascosa JM, Daudén E, Ferrándiz C, Hernanz JM, et al. Documento de consenso sobre la evaluación y el tratamiento de la psoriasis moderada/grave del Grupo Español de Psoriasis de la Academia Española de Dermatología y Venereología. Actas Dermosifiliogr 100:277-86, 2009.
31. Beglinger C, Dudler J, Mottet C, Nicod L, Seibold F, Villiger PM, et al. Screening for tuberculosis infection before initiation of anti-TNF-a therapy. Swiss Med Wkly 137:621-2, 2007.
32. Gupta A, Street AC, Macrae A. Tumor necrosis factor a inhibitors: screening for tuberculosis infection in inflammatory bowel disease. MJA 188:168-70, 2008.
33. Canadian Tuberculosis Committee. Updated recommendations on interferon gamma release assays for latent tuberculosis infection. Can Commun Dis Rep 34:1-13, 2008.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



