|
|
Recepción del artículo: 4 de noviembre, 2011
|
|
Aprobación: 17 de mayo, 2012
|
 Conclusión breve
Conclusión breve
Se necesita comprender con precisión la patología tumoral del cáncer de tiroides y su comportamiento biológico, para aprovechar estos parámetros en una terapia rentable con utilización adecuada de recursos. La apreciación del significado de los factores pronósticos y la estratificación por grupos de riesgo es esencial para el enfoque actual de la enfermedad.
 Resumen
Resumen
Se describe una creciente incidencia de carcinoma de tiroides en todo el mundo, pero la mayor parte de estos casos corresponde a cánceres de bajo riesgo. Se necesita comprender con precisión la patología tumoral y su comportamiento biológico, para aprovechar estos parámetros en una terapia rentable con utilización adecuada de recursos. La apreciación de la importancia y el significado de los factores pronósticos y la estratificación por grupos de riesgo es esencial para el enfoque actual del carcinoma tiroideo. Se requiere discreción para la selección del tratamiento quirúrgico y la indicación de terapias adyuvantes, así como para las estrategias de vigilancia.
 Palabras clave
Palabras clave
cáncer de tiroides, tiroidectomía, factores pronósticos
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/124947
Especialidades
 Principal: Endocrinología y Metabolismo, Oncología,
Principal: Endocrinología y Metabolismo, Oncología,
 Relacionadas: Anatomía Patológica, Atención Primaria, Cirugía, Diagnóstico por Imágenes, Diagnóstico por Laboratorio, Medicina Interna, Medicina Nuclear,
Relacionadas: Anatomía Patológica, Atención Primaria, Cirugía, Diagnóstico por Imágenes, Diagnóstico por Laboratorio, Medicina Interna, Medicina Nuclear,
 Enviar correspondencia a:
Enviar correspondencia a:
Jatin P Shah, Memorial Sloan-Kettering Cancer Center, 10065, New York, EE.UU.
Exploiting biology in selecting treatment for differentiated cancer of the thyroid gland
 Abstract
Abstract
There is a rising incidence of thyroid carcinoma worldwide but a majority of these are favorable low risk cancers. We need to understand accurate pathological interpretation of the nature of the tumor and its biological behavior and exploit it to deliver cost-effective treatment and for proper resource utilization. Appreciation of the importance and significance of prognostic factors and risk group stratification is crucial to contemporary management of thyroid carcinoma. Discretion needs to be employed in selection of surgical treatment and use of adjuvant therapy as well as surveillance strategies.
 Key words
Key words
thyroid cancer, thyroidectomy, prognosis factors
OPTIMIZACIÓN DEL TRATAMIENTO Y SEGUIMIENTO DEL CÁNCER DE TIROIDES
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Incidencia
La incidencia de cáncer de tiroides se ha incrementado en todo el mundo. En Estados Unidos, durante los últimos 30 años se ha informado un aumento del 300%. A pesar de ese acentuado incremento en la incidencia de pacientes con diagnóstico de cáncer de tiroides, la mortalidad asociada con la enfermedad se mantiene estable. En los datos del programa SEER (Surveillance, Epidemiology and End Results) se indica que el carcinoma papilar es la neoplasia con mayor aumento de casos entre los tumores de cabeza y cuello en Estados Unidos.1-4 La mayoría de estos cánceres se describen en mujeres jóvenes. Por fortuna, la mayor parte de estos pacientes se presentan con enfermedad subclínica (carcinomas micropapilares). En muchos casos se trata de incidentalomas, diagnosticados en el examen ecográfico de rutina de la glándula tiroides, otros estudios por imágenes del cuello efectuados por otros motivos en lo cuales se descubre una masa tiroidea, o un examen físico de rutina. La mayoría de estos tumores son carcinomas papilares; en el 87% de estos enfermos, las lesiones de reciente diagnóstico tienen un diámetro menor de 2 cm y, en la mitad de los casos, son menores de 1 cm.5 Si no son descubiertos en forma accidental, muchos de estos tumores permanecen clínicamente ocultos a lo largo de la vida del paciente. Estos tumores con curables en forma casi sistemática y, en consecuencia, no generan repercusiones relevantes sobre la mortalidad atribuida a los carcinomas tiroideos.
Comportamiento biológico
La presencia de focos microscópicos multifocales de carcinoma tiroideo diferenciado (CDT) es común y la mayor parte de los casos se describen en pacientes jóvenes con carcinoma papilar. Esta multiplicidad intraglandular del carcinoma papilar no empeora el pronóstico.6 De igual forma, las micrometástasis ocultas en los ganglios linfáticos regionales son frecuentes en los carcinomas papilares de sujetos jóvenes. Esta diseminación a los ganglios regionales tampoco genera repercusiones adversas sobre el pronóstico.6-7 Así, suele denominarse al carcinoma papilar tiroideo como “neoplasia única”, ya que la diseminación microscópica del tumor primitivo con focos multicéntricos en la glándula tiroides y las micrometástasis en los ganglios linfáticos regionales son frecuentes y precoces en la evolución de la enfermedad, aunque no se vinculan con significación clínica relevante o repercusiones negativas en el pronóstico.
Si se comprende la progresión biológica del CDT, su comportamiento clínico y el abordaje quirúrgico resultan relativamente simples. El CDT se origina en las células foliculares y puede diferenciarse como carcinoma papilar o folicular. Una gran mayoría de estas neoplasias, después del tratamiento inicial, permanecen controladas y se curan sin recurrencia o diseminación. Sin embargo, una pequeña proporción de pacientes evolucionan con progresión a formas menos diferenciadas de carcinoma y se presentan como la variante de células altas del carcinoma papilar o el carcinoma insular. En las condiciones apropiadas, esta progresión tumoral puede continuar hacia formas poco diferenciadas o indiferenciadas de carcinoma. Este modelo de progresión tumoral puede incluso dar lugar al carcinoma anaplásico (Figura 1).
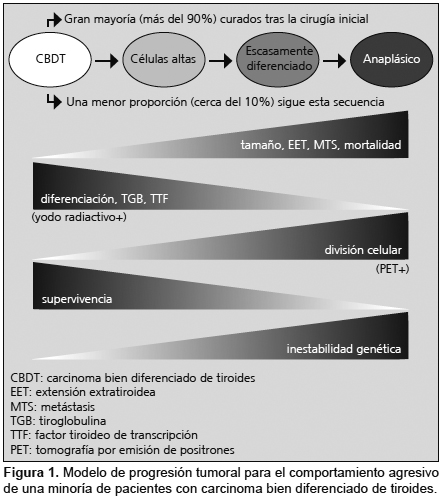
La información acerca de la progresión desde un carcinoma bien diferenciado a un carcinoma anaplásico ha sido fundamentada por 2 observaciones: 1) En los múltiples cortes histopatológicos del tumor primitivo de un paciente con carcinoma poco diferenciado suelen describirse áreas con patrón papilar o folicular bien diferenciados. Este hallazgo significa que el tumor se inició como un cáncer bien diferenciado y progresó a una variante poco diferenciada.8-10 2) En la revisión de las muestras seriadas de histopatología de los individuos con múltiples recurrencias se demostraron cambios metaplásicos progresivos desde un carcinoma inicial bien diferenciado a formas progresivamente menos diferenciadas en cada una de las recurrencias. Muchos de estos enfermos tenderán a presentar cáncer recurrente poco diferenciado, con mayor riesgo de mortalidad.11 Afortunadamente, alrededor del 80% de los pacientes tienen un carcinoma bien diferenciado en su presentación inicial, con excelente pronóstico; cerca del 15% de los enfermos presentan una variedad menos diferenciada o un carcinoma escasamente diferenciado, y aproximadamente entre el 1% y el 2% de los pacientes tienen un carcinoma anaplásico. La mortalidad específica en los enfermos con CDT es inferior al 2%.12 La mortalidad en pacientes con carcinoma anaplásico es superior al 95%, mientras que en el grupo intermedio de sujetos con carcinomas moderadamente diferenciados o escasamente diferenciados oscila entre el 15% y el 35%. En función del modelo de progresión desde un carcinoma papilar bien diferenciado hasta un carcinoma anaplásico, la mortalidad comienza a incrementarse. La diferenciación tumoral es cada vez menor y, por lo tanto, los marcadores de diferenciación tumoral y los parámetros inmunohistoquímicos como la tiroglobulina y el factor tiroideo de transcripción tipo 1 (TTF-1) se hacen menos útiles. De hecho, la tiroglobulina y el TTF-1 son negativos en los pacientes con carcinoma escasamente diferenciado o carcinoma anaplásico. Por otra parte, dado que la diferenciación se hace menos destacada en el marco de la progresión tumoral, la división celular se acelera, por lo cual el tumor incrementa su actividad metabólica. Este comportamiento biológico puede aprovecharse en el tratamiento de los pacientes; los sujetos con CDT pueden identificarse por la avidez por el yodo radiactivo en las pruebas de captación y, en consecuencia, la terapia con este producto puede indicarse para el tratamiento de la enfermedad residual o recurrente. Sin embargo, a medida que el tumor tiende a una menor diferenciación, la avidez por el yodo se reduce, la actividad metabólica se incrementa y la utilización de yodo radiactivo con fines diagnósticos o terapéuticos es cada vez menos útil. En el contexto de la mayor actividad metabólica del tumor, la tomografía por emisión de positrones (PET) con 18-fluoro-desoxi-glucosa se considera una herramienta importante para el diagnóstico del tumor primario y su diseminación metastásica. Los parámetros habituales de pronóstico (tamaño tumoral, histología y edad) también forman parte del modelo de progresión del tumor. Las neoplasias menos diferenciadas son en general de mayor tamaño y suelen diagnosticarse en pacientes ancianos; como contrapartida, los carcinomas micropapilares bien diferenciados se describen en general en individuos jóvenes.
Práctica clínica habitual
El paradigma de la terapia del CDT en muchas instituciones es la tiroidectomía subtotal o casi total, sucedida de la ablación y el tratamiento con yodo radiactivo. Las normativas publicadas por la British Thyroid Association (BTA) proponen la tiroidectomía total o casi total para el carcinoma papilar mayor de 1 cm.13 Además, las recomendaciones de la BTA sugieren la disección electiva del compartimiento ganglionar central en todos los pacientes. No se ha demostrado nunca que este procedimiento se asocie con repercusiones favorables en el pronóstico, al tiempo que incrementaría el riesgo de hipoparatiroidismo. De igual forma, las normativas de la American Thyroid Association recomiendan la tiroidectomía total o casi total para los tumores mayores de 1.5 cm de localización intratiroidea.14 Por lo tanto, en ambas recomendaciones se acepta la lobectomía ipsilateral para los tumores primarios de 1 a 1.5 cm. De todos modos, no existen datos definitivos en la bibliografía que fundamenten estas recomendaciones en función del tamaño tumoral. Creemos que, en lugar del tamaño, la presencia de extensión extratiroidea es un factor predictivo más grave y definitivo para la historia natural del carcinoma papilar, en forma independiente de las dimensiones. Los pacientes con un CDT primario con extensión extratiroidea presentan un riesgo significativamente superior de recurrencia local (2% contra 0%), regional (12% contra 3%) y a distancia (7% contra 2%), así como de mortalidad específica para la enfermedad (5% contra 1%), en comparación con los enfermos con tumores primarios de localización intratiroidea.
El control periódico mediante ecografía y determinación de la tiroglobulina se utilizan para el seguimiento clínico durante el resto de la vida. La implementación de esta estrategia en todos los pacientes con CDT provoca una utilización extraordinariamente excesiva de recursos para un cáncer relativamente inocuo. Se requiere discreción para aprovechar el comportamiento biológico de este cáncer para el uso apropiado de los recursos y una asistencia rentable.
La magnitud de la cirugía y la ablación posquirúrgica con yodo radiactivo no han demostrado repercusión alguna sobre el pronóstico en distintos estudios con numerosos participantes.15-16 En un trabajo de Hundahl y colaboradores con 53 856 pacientes con CDT de la National Cancer Database del American College of Surgeons, se informó una supervivencia del 100% a los 5 años para los enfermos con CDT en estadio I y II, en forma independiente del procedimiento quirúrgico realizado. En un gran estudio de la Mayo Clinic realizado por Hay y colaboradores,17 la ablación con yodo radiactivo no se asoció con repercusiones sobre el pronóstico eventual de los pacientes con CDT de bajo riesgo. En un reciente trabajo de nuestro propio servicio, se ha demostrado nuevamente que la tiroidectomía total no se vincula con ventajas en términos de la supervivencia y la recurrencia, en comparación con la lobectomía tiroidea en sujetos con cánceres unifocales limitados a la glándula tiroides. Así, una acentuada mayoría de los pacientes con CDT de bajo riesgo son sometidos a una cirugía o una terapia adyuvante que resultan excesivas, sin repercusiones favorables para el pronóstico eventual de la enfermedad.
Factores pronósticos y estratificación del riesgo
Se señalado en forma sistemática que los factores pronósticos en el CDT son de vital importancia para la elección de la terapia y la evaluación del pronóstico. En datos de la European Organisation for Research and Treatment of Cancer, de distintos estudios estadounidenses con gran cantidad de pacientes y de ensayos escandinavos, se demostró que los parámetros pronósticos independientes del CDT son relativamente frecuentes.6,18,19 Estas variables pronósticas resultaron uniformes en el análisis multivariado de cada una de las respectivas bases de datos. Los parámetros incluyen la edad, el sexo, el tamaño del tumor primario, la extensión extratiroidea, la histología y las metástasis a distancia. Se trata del único cáncer en los seres humanos en el cual la edad del paciente se mantiene como un parámetro pronóstico independiente en el análisis multivariado. El tamaño tumoral y la extensión extratiroidea son otras variables relevantes asociadas con el pronóstico y, de hecho, la extensión extratiroidea es un factor predictivo destacado del posterior comportamiento tumoral. En los pacientes que se presentan con un tumor primario asociado con compromiso extratiroideo se observa un incremento significativo del riesgo de recurrencia local y de metástasis regionales y a distancia. Como se señaló con anterioridad, la histología escasamente diferenciada es un factor destacado con repercusiones negativas sobre el pronóstico. Los pacientes adultos con metástasis a distancia tienen una supervivencia de sólo el 50% a largo plazo, en comparación con más del doble en aquellos individuos sin signos de metástasis en la presentación inicial. Es tan acentuada la repercusión de la edad sobre el pronóstico que, durante un seguimiento de 20 años para los pacientes tratados en nuestra institución, ningún enfermo menor de 45 años con metástasis al momento de la presentación ha fallecido como consecuencia de la enfermedad.
La utilización de estos parámetros pronósticos independientes para la estratificación en grupos de riesgo resulta clínicamente relevante para la selección del tratamiento.20 Los pacientes de bajo riesgo son jóvenes (menores de 45 años), con un diámetro tumoral menor de 4 cm sin extensión extratiroidea, con histología con buena diferenciación y sin signos de metástasis a distancia. Los enfermos en el grupo de alto riesgo tienen mayor edad (por encima de 45 años), con tumores de mayores dimensiones y extensión extratiroidea, histología con escasa diferenciación o presencia de metástasis a distancia al momento del diagnóstico inicial. El grupo de riesgo intermedio consiste en sujetos jóvenes con tumores primarios agresivos o pacientes de mayor edad con tumores primarios de pronóstico favorable. La mortalidad específica para la enfermedad en el grupo de bajo riesgo es casi nula, mientras que la tasa de letalidad en el grupo de alto riesgo es cercana al 10%. De la misma forma, el fracaso terapéutico con recurrencias se describe en menos del 5% en los pacientes del grupo de bajo riesgo, en comparación con más del 15% entre los individuos de alto riesgo. Afortunadamente, los fracasos terapéuticos en el grupo de bajo riesgo ocurren con metástasis regionales que son tratables y curables.21 Por el contrario, en el grupo de alto riesgo, el fracaso terapéutico se expresa en la mayoría de los pacientes con recurrencias locales, metástasis a distancia o ambas, con menor probabilidad de curación y mayor mortalidad asociada con la enfermedad.
Elección del tratamiento
La estratificación en grupos de riesgo para la elección de la terapia quirúrgica inicial es muy importante. Los pacientes del grupo de bajo riesgo con tumores intraglandulares unifocales con un lóbulo tiroideo contralateral normal tienen una elevada probabilidad de curación mediante una lobectomía tiroidea simple ipsilateral extracapsular. Como se mencionó con anterioridad, la extensión extratiroidea resulta más importante que el tamaño. Así, en un paciente de bajo riesgo, cualquier tumor completamente intratiroideo limitado a un solo lóbulo, en forma independiente del tamaño y con un lóbulo opuesto normal, puede ser bien tratado tanto con una lobectomía tiroidea ipsilateral extracapsular como con una tiroidectomía total. En estos pacientes no se observan beneficios adicionales con la tiroidectomía total o la ablación con yodo radiactivo. En un análisis pareado de enfermos en quienes se efectuó una lobectomía en comparación con aquellos en quienes se realizó una tiroidectomía total, se demostró que la supervivencia a largo plazo en ambos grupos era comparable, así como se informaron similares índices de recurrencia local y de metástasis regionales o a distancia, de modo independiente de la extensión de la resección quirúrgica inicial.22 En el análisis multivariado de una cohorte de pacientes de bajo riesgo tratados entre 1986 y 2008 en nuestra institución, también se observó que la extensión de la cirugía y la administración de yodo radiactivo no afectaban las tasas de supervivencia y recurrencia. Por lo tanto, la lobectomía tiroidea ipsilateral extracapsular es una terapia apropiada para los pacientes de bajo riesgo con un tumor intraglandular unifocal con lóbulo contralateral normal. Esta intervención quirúrgica inicial es curativa para la gran mayoría de los enfermos de bajo riesgo.
Por otra parte, los sujetos con tumores más agresivos con extensión extratiroidea o escasamente diferenciados en la histología requieren de una cirugía apropiada y de mayor magnitud. Se indica la tiroidectomía total en pacientes con enfermedad difusa de ambos lóbulos, presencia de nódulos en el lóbulo tiroideo contralateral en forma independiente de su histología, metástasis ganglionares cervicales masivas en pacientes que requerirán terapia con yodo radiactivo y, por supuesto, en sujetos con metástasis a distancia para facilitar el tratamiento con yodo radiactivo. Cuando se lleva a cabo la tiroidectomía total, se debe realizar con técnica extracapsular sin dejar restos de tejido tiroideo en forma deliberada. En este contexto, las populares técnicas de tiroidectomía subtotal y tiroidectomía casi total no deben efectuarse si la cirugía se realiza con diagnóstico o sospecha de cáncer. La real cirugía oncológica para un enfermo que requiere una resección bilobar consiste en la tiroidectomía total extracapsular completa.
En los pacientes que se presentan con extensión extratiroidea importante y compromiso de la laringe, la tráquea, el esófago o el nervio laríngeo recurrente, se necesita más que una tiroidectomía total para lograr la resección completa de la enfermedad. En consecuencia, pueden requerirse cirugías extensas con resección de segmentos de la laringe, la tráquea, el esófago y el nervio recurrente laríngeo para cumplir el objetivo de la exéresis completa del tumor. De hecho, en los pacientes jóvenes en quienes se realiza una resección tumoral masiva completa de estas características se observa un excelente pronóstico a largo plazo, comparable al de aquellos sujetos sin extensión extratiroidea del tumor primario.23 Estos resultados fueron confirmados en un reciente análisis de los pacientes menores de 45 años con extensión extratiroidea o sin ella que fueron asistidos en nuestra institución, en el cual no se reconocieron casos de mortalidad en ninguno de los grupos durante el seguimiento. La exéresis completa de la masa tumoral se asocia con un pronóstico decididamente mejor en comparación con aquellos pacientes en los cuales permanece masa tumoral residual.24
Metástasis en los ganglios cervicales
Se han definido los patrones de metástasis ganglionares regionales para los CDT. Los ganglios peritiroideos del compartimiento central y los ubicados en el mediastino superior y el surco traqueoesofágico constituyen la primera estación ganglionar de la mayoría de los pacientes con cáncer de tiroides. La posterior diseminación metastásica a los ganglios yugulares inferiores y superiores sucede de un modo predecible y progresivo. Las metástasis microscópicas u ocultas pueden estar presentes en hasta el 50% al 60% de los pacientes con carcinoma papilar y una palpación cervical clínicamente negativa (N0).25,26 Pese a la elevada incidencia de micrometástasis ocultas en los ganglios cervicales regionales, las subsecuentes metástasis clínicas se observan en menos del 15% de los enfermos. La supervivencia después de la disección cervical terapéutica es tan adecuada como la de los pacientes en quienes se realiza este procedimiento de forma electiva. Por lo tanto, en ausencia de metástasis ganglionares reconocidas por palpación clínica o radiología, no se recomienda la exéresis electiva de los ganglios cervicales. No obstante, si durante la realización de la tiroidectomía se reconocen adenopatías en el compartimiento central del cuello, es posible confirmar la presencia de metástasis mediante la evaluación histológica por congelación de una lesión sospechosa y, a continuación, proceder a la extirpación sistemática de los ganglios de este compartimiento. En este contexto, no se recomienda la disección lateral del cuello. Cuando se han confirmado metástasis ganglionares cervicales por el examen clínico o los estudios por imágenes, se recomienda la exéresis sistemática de los ganglios regionales mediante disección cervical modificada. No se recomienda la remoción de las adenopatías de apariencia macroscópica patológica (berry picking), dado que el procedimiento puede dar lugar a múltiples recurrencia de metástasis ganglionares, con necesidad de cirugías repetidas e incremento de la morbilidad.
Las metástasis ganglionares regionales en los pacientes jóvenes no se asocian con repercusiones sobre el pronóstico a largo plazo. Estos enfermos, con metástasis ganglionares regionales o sin ellas, se caracterizan por una supervivencia a largo plazo cercana al 100%. Como contrapartida, la presencia de metástasis ganglionares regionales en sujetos de mayor edad se vincula con un peor pronóstico.7 En la reciente experiencia de nuestra institución, los individuos de más de 45 años tienen una tasa de supervivencia específica del 93% a 5 años en presencia de metástasis ganglionares, en comparación con una tasa del 98% para el estadio N0.
Terapia adyuvante posoperatoria
Muchos expertos proponen la ablación sistemática después de la tiroidectomía total, con el fundamento de la destrucción del tejido tiroideo remanente y la posibilidad de efectuar un seguimiento con determinaciones seriadas de los niveles de tiroglobulina. Se ha definido que la ablación del tejido tiroideo remanente no tiene repercusiones sobre el pronóstico de los pacientes de bajo riesgo.17 Sin embargo, cuando se ha efectuado una tiroidectomía real extracapsular y los niveles de tiroglobulina son inferiores a 1 ng/ml a las 6 semanas del procedimiento, no resulta sencillo justificar la indicación posoperatoria de yodo radiactivo. En consecuencia, no prescribimos esta ablación salvo en aquellos pacientes en los cuales la tiroglobulina permanezca elevada después de una tiroidectomía total. Tras la ablación con yodo radiactivo, en general es difícil alcanzar niveles circulantes nulos de tiroglobulina. Sin embargo, una determinación por debajo de 1 ng/ml se considera aceptable para declarar al paciente “libre de cáncer”. Se emplea la dosimetría del yodo radiactivo para definir la dosis correcta para ser administrada.
Seguimiento a largo plazo y vigilancia
Los pacientes de bajo riesgo con CDT se mantienen bajo vigilancia clínica, inicialmente con intervalos de 6 meses y luego con controles anuales. Además del examen físico, se efectúan determinaciones de la tiroglobulina en cada uno de estos controles. Las fluctuaciones menores en los valores de esta molécula son de escasa relevancia clínica; no obstante, la elevación significativa de los valores de tiroglobulina motiva la necesidad de una evaluación más profunda para descartar un recurrencia de la enfermedad.
La ecografía del lecho tiroideo y la región lateral del cuello se realiza en forma anual durante los primeros 5 años. La mayoría de los pacientes con riesgo de enfermedad recurrente en el lecho tiroideo o la región lateral del cuello presentan recurrencias dentro de los primeros 3 a 5 años. La realización de determinaciones anuales de los niveles de tiroglobulina en los posteriores controles es suficiente para el seguimiento a largo plazo de los pacientes con cáncer de tiroides de bajo riesgo.
En aquellos sujetos que se consideran de alto riesgo, se requiere una vigilancia más estricta e incluso pueden necesitar una PET, además de las ecografías y las determinaciones de tiroglobulina. Los enfermos con carcinoma escasamente diferenciado tienen una menor probabilidad de presentar neoplasias con avidez por el yodo; en consecuencia, no parecen candidatos a la detección de recurrencias por marcación con yodo radiactivo o determinación de los niveles de tiroglobulina. En estos pacientes podría verificarse una recurrencia mediante PET, ya sea en el cuello o en otras áreas. La heterogeneidad tumoral es frecuente en el cáncer de tiroides y algunos pacientes pueden presentar tanto enfermedad detectable por PET en otras áreas del organismo como metástasis ávidas de yodo. Las variantes más agresivas del cáncer de tiroides se caracterizan por positividad en la PET, mientras que el componente más diferenciado de las metástasis se visualiza en el rastreo con yodo radiactivo. Por lo tanto, esos enfermos pueden presentar resultados positivos tanto en la PET como el rastreo con yodo. De todos modos, en general, los CDT tienen avidez por el yodo, mientras que la positividad en la PET se incrementa en presencia de tumores menos diferenciados.
Las metástasis identificadas mediante PET pueden requerir una intervención quirúrgica o bien radioterapia externa. Las recurrencias o las metástasis con avidez por el yodo se tratan con yodo radiactivo. La vigilancia excesiva de los pacientes de bajo riesgo con técnicas ultrasensibles de determinación de tiroglobulina y uso repetido de la ecografía puede resultar problemática en algunos enfermos. Las variaciones menores de los valores de tiroglobulina motivan la necesidad de una ecografía, en la cual pueden demostrarse ganglios linfáticos pequeños (menores de 1 cm) en el compartimiento cervical central. Este hallazgo desencadena la necesidad de una biopsia por punción y aspiración con aguja fina, en la cual puede demostrarse una metástasis ganglionar de carcinoma papilar. Estas lesiones tienen baja repercusión sobre el pronóstico, pero se convierte en una causa principal de angustia, aprehensión y preocupación para el paciente, quien puede obsesionarse con el temor a una recurrencia y solicitar una intervención quirúrgica. El descubrimiento de estas pequeñas metástasis de carcinoma papilar en los ganglios linfáticos regionales pueden ocurrir en más de una oportunidad; cada nueva intervención quirúrgica se asocia con un mayor riesgo por la posibilidad de lesión de las glándulas paratiroides y del nervio laríngeo recurrente. De este modo, se requieren restricciones para la determinación ultrasensible de tiroglobulina y la repetición de las ecografías en los pacientes de bajo riesgo. En general, no proponemos la biopsia con aspiración con aguja fina de los ganglios linfáticos menores de 1 cm de diámetro. Proponemos el seguimiento con ecografías seriadas y consideramos la aspiración con aguja fina sólo si el diámetro del ganglio identificado es mayor de 1 cm o si en un ganglio de menores dimensiones se verifica crecimiento en las distintas ecografías.
Mortalidad por cáncer de tiroides
En el análisis de la mortalidad específica para la enfermedad en pacientes con carcinoma de tiroides, se observa que el 2% de todas estas neoplasias son carcinomas anaplásicos, pero que se asocian con una tasa de letalidad del 85%. El 4% de los pacientes presentan carcinomas medulares, con una mortalidad del 25%. Los CDT en estadio IV corresponden a sólo el 1% de todos los cánceres de tiroides, con una tasa de mortalidad del 50%. Por lo tanto, la mayoría de los casos de mortalidad específica para la enfermedad en sujetos con carcinoma de tiroides se atribuyen a la letalidad por carcinoma anaplásico, carcinoma medular, carcinoma escasamente diferenciado y CDT en estadio IV localmente agresivo.
La mortalidad en los pacientes de bajo riesgo es excepcional. En una serie de casos consecutivos de sujetos de bajo riesgo tratados en la Mayo Clinic, la mortalidad a los 10 años luego del tratamiento inicial fue nula.17 En una serie de 1 810 pacientes consecutivos tratados quirúrgicamente en nuestra institución, la tasa global de mortalidad específica para la enfermedad fue del 1.3%; la letalidad en los sujetos de bajo riesgo resultó nula. La mayoría de los pacientes que podrían morir de cáncer de tiroides pueden identificarse al momento del tratamiento inicial, por lo cual es posible indicar una intervención quirúrgica agresiva, una terapia adyuvante de mayor intensidad y una vigilancia más estrecha después del tratamiento. La comprensión del diagnóstico histológico y del comportamiento biológico del cáncer tiroideo permite la selección de una intervención quirúrgica apropiada, una utilización adecuada de recursos y una terapia rentable.
Perspectivas futuras
Necesitamos reorganizar nuestras prioridades en el enfoque de los pacientes con CDT. Se requiere reducir los esfuerzos dirigidos a identificar la presencia de enfermedad microscópica o de poca magnitud en individuos con carcinoma diferenciado, dado que estos hallazgos no se asocian con repercusiones sobre el pronóstico. La mayor parte de los pacientes tratados en la actualidad por un cáncer de tiroides pertenecen al grupo de bajo riesgo y podrían ser sometidos en forma innecesaria a cirugías agresivas y a la terapia adyuvante.
Por otra parte, necesitamos incrementar nuestros esfuerzos e invertir recursos en investigación básica para identificar parámetros moleculares para el diagnóstico y el pronóstico de los individuos con alto riesgo de mortalidad por cáncer de tiroides. El reconocimiento de marcadores moleculares con fines pronósticos podría permitir la creación de nuevas estrategias terapéuticas para salvar la vida de los individuos con riesgo de mortalidad por cáncer de tiroides. Pese a los numerosos informes que describen distintos marcadores moleculares para el pronóstico, ninguno de estos parámetros cuenta con aplicaciones clínicas.
 Bibliografía del artículo
Bibliografía del artículo
1. Davies L, Welch HG. Epidemiology of head and neck cancer in the United States. Otolaryngol Head Neck Surg 135(3):451-7, 2006.
2. Chen AY, Jemal A, Ward AM. Increasing incidence of differentiated thyroid cancer in the United States, 1988-2005. Cancer 115(16):3801-7, 2009.
3. Enewold L, et al. Rising thyroid cancer incidence in the United States by demographic and tumor characteristics, 1980-2005. Cancer Epidemiol Biomarkers Prev 18(3):784-91, 2009.
4. Mitchell I, et al. Trends in thyroid cancer demographics and surgical therapy in the United States. Surgery 142(6):823-8, 2007.
5. Davies L, Welch HG. Increasing incidence of thyroid cancer in the United States, 1973-2002. JAMA 295(18):2164-7, 2006.
6. Shah JP, et al. Prognostic factors in differentiated carcinoma of the thyroid gland. Am J Surg 164(6):658-61, 1992.
7. Hughes CJ, et al. Impact of lymph node metastasis in differentiated carcinoma of the thyroid: a matched-pair analysis. Head Neck 18(2):127-32, 1996.
8. Sywak M, Pasieka JL, Ogilvie T. A review of thyroid cancer with intermediate differentiation. J Surg Oncol 86(1):44-54, 2004.
9. Rosai J. Poorly differentiated thyroid carcinoma: introduction to the issue, its landmarks, and clinical impact. Endocr Pathol 15(4):293-6, 2004.
10. Rosai J, Saxen EA, Woolner L. Undifferentiated and poorly differentiated carcinoma. Semin Diagn Pathol 2(2):123-36, 1985.
11. Hutter RV, et al. Spindle and giant cell metaplasia in papillary carcinoma of the thyroid. Am J Surg 110(4):660-8, 1965.
12. Nixon IJ, et al. Disease-Related Death in Patients Who Were Considered Free of Macroscopic Disease After Initial Treatment of Well-Differentiated Thyroid Carcinoma. Thyroid; 2011.
13. Watkinson JC. The British Thyroid Association guidelines for the management of thyroid cancer in adults. Nucl Med Commun 25(9):897-900, 2004.
14. Cooper DS, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 19(11):1167-214, 2009.
15. Hay ID, et al. Predicting outcome in papillary thyroid carcinoma: development of a reliable prognostic scoring system in a cohort of 1779 patients surgically treated at one institution during 1940 through 1989. Surgery 114(6):1050-7, 1993.
16. Hundahl SA, et al. A National Cancer Data Base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995. Cancer 83(12):2638-48, 1998.
17. Hay ID, et al. Papillary thyroid carcinoma managed at the Mayo Clinic during six decades (1940-1999): temporal trends in initial therapy and long-term outcome in 2444 consecutively treated patients. World J Surg 26(8):879-85, 2002.
18. Cady B, Hayes M. Our AMES is true: how an old concept still hits the mark: or, risk group assignment points the arrow to rational therapy selection in differentiated thyroid cancer. Am J Surg 174(5):462-8, 1997.
19. McConahey WM, et al. Papillary thyroid cancer treated at the Mayo Clinic, 1946 through 1970: initial manifestations, pathologic findings, therapy, and outcome. Mayo Clin Proc 61(12):978-96, 1986.
20. Shaha AR, Shah JP, Loree TR. Risk group stratification and prognostic factors in papillary carcinoma of thyroid. Ann Surg Oncol 3(6):534-8, 1996.
21. Shaha AR, Shah JP, Loree TR. Low-risk differentiated thyroid cancer: the need for selective treatment. Ann Surg Oncol 4(4):328-33, 1997.
22. Shah JP, et al. Lobectomy versus total thyroidectomy for differentiated carcinoma of the thyroid: a matched-pair analysis. Am J Surg 166(4):331-5, 1993.
23. Andersen PE, et al. Differentiated carcinoma of the thyroid with extrathyroidal extension. Am J Surg 170(5):467-70, 1995.
24. McCaffrey TV, Bergstralh EJ, Hay ID. Locally invasive papillary thyroid carcinoma: 1940-1990. Head Neck 16(2):165-72, 1994.
25. Koo BS, et al. Predictive factors for ipsilateral or contralateral central lymph node metastasis in unilateral papillary thyroid carcinoma. Ann Surg 249(5):840-4, 2009.
26. Vergez S, et al. Lymph node management in clinically node-negative patients with papillary thyroid carcinoma.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



