|
|
Recepción del artículo: 24 de noviembre, 2011
|
|
Aprobación: 2 de agosto, 2012
|
 Conclusión breve
Conclusión breve
La ecografía Doppler transcraneal y el dúplex carotídeo pueden realizarse mediante dispositivos portátiles, lo que permite su utilización junto a la cama del paciente en el Servicio de Urgencias y en la sala de neurointervencionismo.
 Resumen
Resumen
La ecografía Doppler transcraneal (EDTC) y el dúplex carotídeo (DC) pueden realizarse mediante dispositivos portátiles, lo que permite su utilización junto a la cama del paciente en el Servicio de Urgencias y en la sala de neurointervencionismo. Ambas técnicas permiten el diagnóstico del estado del árbol vascular cerebral y facilitan un diagnóstico rápido y una decisión terapéutica adecuada. Existe una creciente utilización del dúplex transcraneal (DuTC), que nos permite, además, la valoración del parénquima cerebral, lo que es especialmente útil en la monitorización de la evolución de las hemorragias cerebrales, el efecto masa intracraneal y la hidrocefalia. Finalmente, la EDTC tiene un efecto terapéutico, ya que potencia la recanalización con activador tisular del plasminógeno (tPA). La EDTC, el DuTC y el DC son herramientas diagnósticas excelentes que deberían utilizarse en la evaluación inmediata de todos los pacientes con ictus isquémico o hemorrágico agudo.
 Palabras clave
Palabras clave
ultrasonido transcraneal, ultrasonido carotídeo, ecocontrastes, infarto cerebral, hemorragia cerebral
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/122656
Especialidades
 Principal: Cuidados Intensivos, Diagnóstico por Imágenes,
Principal: Cuidados Intensivos, Diagnóstico por Imágenes,
 Relacionadas: Emergentología, Geriatría, Medicina Interna, Neurocirugía, Neurología, Salud Pública,
Relacionadas: Emergentología, Geriatría, Medicina Interna, Neurocirugía, Neurología, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
Patricia Martínez Sánchez, Hospital Universitario La Paz Centro de Ictus y Servicio de Neurología, Madrid, España
Portable ultrasound equipment of use in diagnosing acute ictus
 Abstract
Abstract
Transcranial Doppler (TCD) and carotid duplex (CD) can be used as portable tests, thus allowing for bedside use in the Emergency Service and Neurointerventional Room. Both tests broaden the abilities of the stroke neurologist to rapidly evaluate the vascular tree, facilitating a rapid diagnosis and appropriate therapeutic decisions. There is a growing use of transcranial duplex (TCDu), which also allows assessment of the brain parenchyma, which is especially useful in monitoring the evolution of brain hemorrhage, intracranial mass effect and hydrocephalus. Finally, the TCD has a therapeutic effect because it enhances arterial recanalization after tPA administration. The TCD, TCDu and CD are excellent diagnostic tools that should be used in all patients with ischemic or hemorrhagic stroke.
 Key words
Key words
transcranial ultrasound, carotid ultrasound, microbubble contrast agents, brain infarction, cerebral hemorrhage
EL ULTRASONIDO CON DISPOSITIVOS PORTÁTILES ES ÚTIL PARA EL DIAGNÓSTICO DEL ICTUS AGUDO
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
Las técnicas neurosonológicas son herramientas fáciles de utilizar y de bajo costo que nos permiten la valoración urgente del paciente con ictus agudo. Además, tanto la ecografía Doppler transcraneal (EDTC) como el dúplex transcraneal (DuTC) y el dúplex carotídeo (DC) pueden realizarse con dispositivos portátiles, lo que favorece su utilización inmediata, incluso en el Servicio de Urgencias.
En el ictus isquémico agudo, la neurosonología permite la monitorización de las arterias cerebrales intracraneales y extracraneales, facilitando la indicación de terapias de reperfusión1,2 y ayudando a establecer un pronóstico clínico3-6 en poco tiempo. Además, la EDTC tiene un efecto terapéutico al potenciar la recanalización tras la administración de activador tisular del plasminógeno (tPA) intravenoso (IV).7
Por otra parte, el DuTC nos permite, además del estudio del polígono de Willis, la valoración del parénquima cerebral, por lo que es una técnica emergente en la monitorización de la evolución de las hemorragias cerebrales, el efecto masa intracraneal y la hidrocefalia.8-10
El DC, además de diagnosticar estenosis carotídeas y la presencia de disecciones, nos proporciona información sobre las características de las placas carotídeas, lo que ayunda a identificar aquellas que son más inestables.11
En el presente trabajo se revisa la utilidad de la EDTC, el DuTC y el DC en la evaluación del ictus isquémico y hemorrágico agudo, con especial énfasis en sus nuevas aplicaciones.
La EDTC en la monitorización de la recanalización arterial luego de tratamientos intravenosos y endovasculares
La monitorización con EDTC en el ictus agudo permite desde evaluar una obstrucción de una arteria intracraneal hasta medir el grado de flujo residual tras la administración de tPA IV.12-14 Estas variaciones del flujo arterial han sido graduadas, plasmándose en la escala de flujo residual Thrombolysis in Brain Ischemia (TIBI).15 Dicha escala establece seis grados de flujo sanguíneo: grado 0 = flujo ausente, grado 1 = flujo mínimo, grado 2 = flujo amortiguado, grado 3 = flujo disminuido, grado 4 = flujo acelerado y grado 5 = flujo normal.13 La clasificación TIBI puede utilizarse en todas las arterias intracraneales, en particular en la región donde presuntamente se encuentra la obstrucción o justo distal a ésta. Los grados de flujo TIBI se correlacionan con la gravedad del ictus isquémico y se corresponden con los grados de recanalización arterial medida por angiografía utilizando la escala TIMI.17 Los pacientes con ictus isquémico agudo que presentan flujo residual en la arteria afectada tienen el doble de probabilidad de recanalización temprana con tPA IV, mientras que los que no, tienen el 20% menos de probabilidad de recanalización.18 Además, una oclusión persistente o una reoclusión tras la fibrinolisis se asocia con un empeoramiento clínico y una peor evolución a largo plazo.5 También se ha descrito que el lugar de la oclusión arterial, establecida con los grados TIBI, se relaciona con la respuesta clínica a la fibrinolisis. Los pacientes con menor probabilidad de una repuesta temprana o tardía al tratamiento fibrinolítico son aquellos en los que no se detecta flujo residual en la arteria intracraneal o que presentan una oclusión distal de la arteria carótida interna (ACI).6
Por otra parte, la EDTC ha sido utilizada para monitorizar la recanalización arterial tras la aplicación de terapias de recanalización endovasculares, como tPA intraarterial (IA), dispositivos de extracción mecánica como el MERCI y el Penumbra, así como angioplastia con stent intracraneal. La inyección del contraste IA produce señales de alta intensidad e incrementa la velocidad media de flujo (VMF). La colocación del dispositivo MERCI provoca señales de corta duración y de alta intensidad con un decremento transitorio de la VMF del 11.5%. El sistema Penumbra produce señales de baja intensidad con un gran decremento de la VMF durante la aspiración. El tPA IA aumenta en un 7.5% la VMF en comparación con el MERCI y el Penumbra. Además, la EDTC en modo M puede detectar en tiempo real la reoclusión arterial, la embolización arteria-arteria, la presencia de embolismo aéreo durante el procedimiento y la hiperperfusión tras las terapias endovasculares.19 Un estudio reciente mostró que el incremento de la velocidad diastólica final (VDF) mediante EDTC se asociaba con la recanalización/reperfusión completa, la mejoría neurológica precoz y la evolución funcional favorable, perfilándose como un nuevo factor predictor del éxito de las terapias de reperfusión.20
Utilidad del DuTC en la monitorización de la recanalización arterial en el ictus isquémico agudo
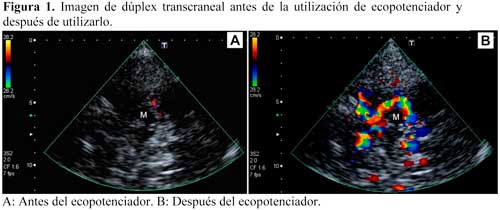
En los últimos años han crecido de manera exponencial los estudios que demuestran la utilidad del DuTC para localizar y establecer el grado de una lesión vascular (oclusión/estenosis).21 Además, varios trabajos han comparado el uso del DuTC en el infarto agudo con técnicas de imagen convencionales, como angioRM, angioTC e incluso arteriografía cerebral, obteniendo buenas correlaciones con todos ellos.22-27 La limitación más importante del DuTC es la mayor frecuencia de ventana temporal inadecuada para realizar el estudio diagnóstico, que se solventa fácilmente con el uso de ecopotenciadores (EP)23 (Figura 1). Sin embargo, es importante saber que los EP incrementan la velocidad de flujo en aproximadamente un 30%.
De la misma manera que se han elaborado los criterios TIBI para establecer el grado de flujo residual mediante la EDTC, una comisión de expertos ha propuesto recientemente los criterios COGIF (Consensus On Grading Intracranial Flow obstruction) para el DuTC:28 un COGIF 1 implicaría la oclusión completa del vaso y la ausencia de flujo (equivale a TIBI 0); el COGIF 2 supone la ausencia de flujo diastólico (equivale a TIBI 1) y sugiere una canalización parcial; en el COGIF 3 coexisten bajas velocidades sistólica y diastólica y también sugiere una recanalización parcial (equivale a los TIBI 2-3), y por último el COGIF 4 corresponde a una perfusión completa, en donde se diferencian 3 subcategorías: flujo normal, flujo estenótico (con aumento de velocidades focales) y flujo aumentado en un segmento o hiperperfusión (engloba los criterios TIBI 4-5) (Figura 2).
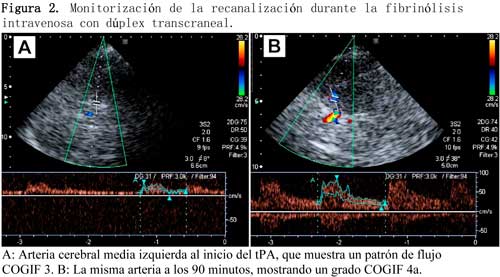
Los criterios COGIG también pueden utilizarse para monitorizar la recanalización del vaso en función de los cambios de la circulación cerebral valorados mediante DuTC. Así, consideraremos las siguientes situaciones: 1) recanalización: existe una mejora en el grado COGIF respecto de la situación basal; 2) recanalización parcial: mejora = 1 grado COGIF respecto del COGIF basal; 3) recanalización completa: mejora desde cualquier grado COGIF basal hasta un grado COGIF 4 final; 4) no hay cambios: no existe una diferencia entre el grado COGIF basal y el final; y 5) empeoramiento: deterioro = 1 grado en la escala COGIF que, en ocasiones, es debido a reestenosis/oclusión del vaso estudiado.28
Los grados COGIF se utilizan, por el momento, en el ámbito de la investigación y se requieren estudios de validación en la práctica clínica.
Ultrasonido transcraneal terapéutico
El ultrasonido (US) transmite energía mecánica al trombo intraarterial, que puede movilizarlo y aumentar su superficie de exposición al tPA, favoreciendo su lisis. El ensayo clínico Combined Lysis of Thrombus in Brain Ischemia Using Transcranial Ultrasound and Systemic TPA (CLOTBUST), demostró que la aplicación continua de ultrasonido mediante EDTC a una frecuencia de 2 MHz en el punto de la oclusión arterial intracraneal potenciaba de manera segura la recanalización tras el tPA IV en pacientes con infarto cerebral, con una tendencia no significativa a una mejor evolución clínica.7
Un estudio analizó los efectos del US con monitorización por EDTC asociado con microburbujas (MB) de galactosa, un contraste ecográfico, en la recanalización de la ACM durante la fibrinólisis IV. La tasa de recanalización con la combinación de tPA + US + MB fue incluso mayor que la obtenida con tPA + US, sin un aumento en la frecuencia de hemorragias intracraneales, y con una tendencia a una mejor evolución clínica a corto y a largo plazo. El mecanismo subyacente a estos resultados es que la destrucción de las MB por el US en la superficie del trombo puede estar asociada con la fragmentación de éste, su disolución, o ambas.29 Un ensayo clínico reciente analizó la eficacia de la infusión de MB de gas perflutren con cubierta lipídica combinadas con tPA IV y EDTC en pacientes con isquemia cerebral aguda. El estudio concluyó que las MB eran seguras a dosis bajas (1.4 ml); sin embargo, las dosis más altas (2.8 ml) se asociaron con la presencia de transformación hemorrágica intracraneal grave, por lo que el estudio se interrumpió de manera prematura.30 Se requieren más estudios para establecer el papel de las MB en la potenciación segura de la fibrinólisis IV.
Por otro lado, varios estudios han analizado la acción del DuTC en la potenciación de la fibrinólisis sistémica en trombosis agudas de la ACM. Aunque el DuTC produce una aceleración de la recanalización y una tendencia a un mejor pronóstico, el número de hemorragias intracraneales sintomáticas y asintomáticas tiende a ser mayor.31 Por ello, son necesarias más investigaciones que prueben si la aplicación transcraneal prolongada de US mediante DuTC durante la trombólisis IV es segura.
El DuTC en la valoración del edema cerebral y el efecto masa intracraneal
El pronóstico del paciente con infarto cerebral se relaciona directamente con la aparición de edema cerebral, sobre todo si se produce a desviación de la línea media. El DuTC nos permite visualizar el parénquima cerebral y los ventrículos, por lo que se vislumbra como una técnica potencialmente útil para el diagnóstico y monitorización del edema y el efecto masa cerebral.
Diversos estudios han demostrado la utilidad de esta técnica para detectar y monitorizar en el tiempo el desplazamiento de la línea media. La medida se lleva a cabo comparando la distancia desde la calota craneal hasta el III ventrículo en ambos lados de la cabeza, lo que ha mostrado una excelente correlación con la TC cerebral.9,32
Estudio del hematoma cerebral mediante DuTC
El DuTC puede evaluar la presencia de hematomas cerebrales, ya que estos se muestran muy ecogénicos en relación con el resto del parénquima cerebral (Figura 3).
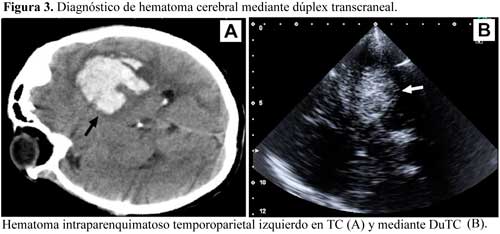
Seidel et al. observaron una alta sensibilidad (90%) y especificidad (97.4%) del DuTC en la detección de transformación hemorrágica en pacientes con infarto cerebral, tanto en los que habían recibido trombólisis como en los que no, y demostraron su aparición en las primeras 60 horas tras el inicio de los síntomas.33
Además, el DuTC también ha demostrado su validez en el diagnóstico y el seguimiento de la evolución de los hematomas intraparenquimatosos a las 6 horas del ingreso, con buena correlación con las imágenes obtenidas mediante TC craneal, tanto en cada uno de los tres diámetros como en el volumen total (r = 0.82, p = 0.001).34 Esto supone una ventaja para el seguimiento de los pacientes con hematoma cerebral, ya que permite evaluarlos a pie de cama, y evitar de esta maneras su traslado a la sala de radiología y la exposición a radiaciones innecesarias.
Papel del DuTC en la monitorización de la hidrocefalia
El DuTC permite la visualización de los ventrículos cerebrales, abriendo un abanico de potenciales utilidades en el paciente con ictus. Un estudio reciente analizó su capacidad para evaluar el aumento de tamaño de los ventrículos en pacientes con hemorragia cerebral e hidrocefalia a los que se les había colocado un drenaje ventricular o lumbar externo y en los que se pretende comenzar a cerrar dicho drenaje por mejoría clínica. Un aumento en la anchura del ventrículo lateral de 5.5 mm tras el cierre del drenaje mostró una alta sensibilidad (100%) y especifilidad (83%) para la indicación de la apertura de dicho drenaje, con una excelente correlación con las imágenes de TC cerebral.10
Caracterización de la placa de ateroma carotídea en el ictus agudo
Hasta hace relativamente poco tiempo, sólo era importante establecer el grado de estenosis de las placas carotídeas sintomáticas en pacientes con ictus agudo, con el fin de indicar tratamientos como la endarterectomía carotídea o la angioplastia. Sin embargo, en los últimos años está cobrando una importancia creciente el analizar también la ecomorfología de la placa, ya que puede ser un factor pronóstico de recurrencia.
La ecogenicidad de la placa de ateroma medida con DC está relacionada con su composición histológica.35,36 Las placas inestables tienen mayor contenido lipídico y, con mayor frecuencia, hemorragias intraplaca, características éstas que están relacionadas con la ecolucencia (baja ecogenicidad). Sin embargo, el tejido fibroso y el calcio, ambos relacionados con placas estables, son más ecogénicos.
La mayor ecolucencia de la placa se asocia con la aparición de eventos isquémicos neurológicos37 y con un incremento en el número de embolias luego de endarterectomía o angioplastia con colocación de stent carotídeo.38,40
El análisis de la ecolucencia de la placa carotídea responsable de una isquemia cerebral aguda podría ser de utilidad para establecer el mecanismo y el riesgo de un evento isquémico. Un estudio reciente ha demostrado que los valores bajos en la mediana de la escala de grises (GSM, del inglés Gray Scale Median) estandarizada de las placas carotídeas con estenosis del 30% al 99% se correlacionan con los síntomas y la presencia de microembolias en EDTC40 (Figura 4). Además, un estudio realizado en nuestro centro ha mostrado que, en pacientes con placas de ateroma carotídeas bilaterales, las placas sintomáticas son más ecolucentes, con un valor umbral de la GSM < 24.5 como factor predictor de síntomas, independientemente del grado de estenosis.41
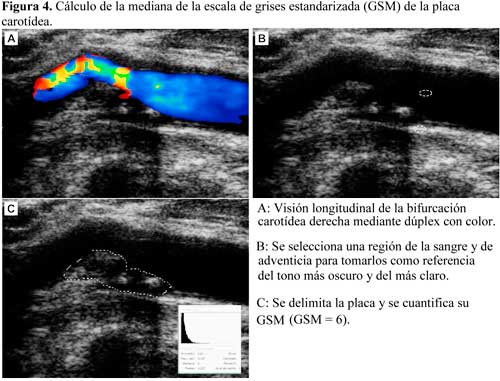
Por otro lado, la ecolucencia de la placa carotídea, medida con la GSM estandarizada, se modifica en las primeras horas o días después de producirse un evento isquémico cerebral, lo que podría ser un indicador precoz de remodelación.42 Sin embargo, se desconoce la utilidad de la monitorización de los cambios de ecolucencia de las placas en la predicción de recurrencias.
Conclusión
El uso de técnicas neurosonológicas ha revolucionado el diagnóstico rápido y a bajo costo del paciente con infarto cerebral agudo, con un efecto terapéutico adicional durante la fibrinólisis. Asimismo, comienzan a mostrar su utilidad en el diagnóstico de las hemorragias cerebrales y en la monitorización de sus complicaciones.
Por todo ello, las técnicas neurosonológicas deben ser una parte esencial de la formación y la práctica en el campo de las afecciones cerebrovasculares.
 Bibliografía del artículo
Bibliografía del artículo
1. Song JK, Cacayorin ED, Campbell MS, y col. Intracranial balloon angioplasty of acute terminal internal carotid artery occlusion. AJNR Am J Neuroradiol 23:1308-1312, 2002.
2. Eckstein HH, Schumacher H, Dorfler A, y col. Carotid endarterectomy and intracranial thrombolysis: simultaneous and staged procedures in ischemic stroke. J Vasc Surg 19:459-471, 1999.
3. Wong KS, Li H, Chan YL, Ahuja A, Lam WWM, Wong A, Kay R. Use of transcranial Doppler ultrasound to predict outcome in patients with intracranial large-artery occlusive disease. Stroke 31:2641-2647, 2000.
4. Purroy F, Montaner J, Delgado P, y col. Usefulness of urgent combined carotid/transcranial ultrasound testing in early prognosis of TIA patients. Med Clin (Barc) 126:647-50, 2006.
5. Saqqur M, Molina CA, Salam A, y col. for the CLOTBUST Investigators. Clinical deterioration after intravenous recombinant tissue plasminogen activator treatment: a multicenter transcranial Doppler study. Stroke 38:69-74, 2007.
6. Saqqur M, Uchino K, Demchuk AM, y col. for the CLOTBUST Investigators. Site of arterial occlusion identified by transcranial Doppler predicts the response to intravenous thrombolysis for stroke. Stroke 38:948-954, 2007.
7. Alexandrov AV, Molina CA, Grotta JC, y col. for the CLOTBUST Investigators. Ultrasound-enhanced thrombolysis for acute ischemic stroke. N Engl J Med 351:2170-2178, 2004.
8. Santamarina E, Delgado-Medeiros R, Rubiera M, y col. Transcranial duplex sonography for monitoring hyperacute intracrerebral hemorrhage. Stroke 40:987-990, 2009.
9. Bertram M, Khoja W, Ringleb P, Schwab S. Transcranial colour-coded sonography for the bedside evaluation of mass effect after stroke. European Journal of Neurology 7:639-646, 2000.
10. Kiphuth IC, Huttner HB, Struffert T, Schwab S, Köhrmann M. Sonographic monitoring of ventricle enlargement in poshemorrhagic hydrocephalus. Neurology 76:858-862, 2011.
11. Martínez-Sánchez P, Ruiz-Ares G, Díez-Tejedor E. Estudio de la placa ateromatosa carotídea. En: Manual de Neurosonología. Ed. Panamericana, Madrid; 2011. pp. 104-116.
12. Chernyshev OY, Garami Z, Calleja S, y col. Yield and accuracy of urgent combined carotid/transcranial ultrasound testing in acute cerebral ischemia. Stroke 36:32-37, 2004.
13. Martínez-Sánchez P, Tsivgoulis G, Lao A, Sharma V, Alexandrov V. Ultrasound in acute ischemic stroke. Neurologia 24(1):59-68, 2009.
14. Martínez Sánchez P, Serena J, Alexandrov AV, Fuentes B, Fernández-Domínguez J, Díez-Tejedor E. Update on ultrasound techniques for the diagnosis of cerebral isquemica. Cerebrovasc Dis 27 Suppl 1:9-18, 2009.
15. Perren F, Loulidi J, Graves R y col. Combined IV-intraarterial thrombolysis: a color-coded duplex pilot study. Neurology 67:324-326, 2006.
16. Demchuk AM, Burgin WS, Christou I, y col. Thrombolysis in brain ischemia (TIBI) transcranial Doppler flow grades predict clearly recovery, and mortality in patients treated with tissue plasminogen activator. Stroke 32:89-93, 2001.
17. Burgin WS, Malkoff M, Felberg RA, y col. Transcranial Doppler ultrasound criteria for recanalization after thormbolysis for middle cerebral artery stroke. Stroke 13:1128-1132, 2000.
18. Labiche LA, Malkoff M, Alexandrov AV. Residual flow signals predict complete recanalization in stroke patients treated with TPA. J Neuroimaging 13:28-33, 2003.
19. Rubiera M, Cava L, Tsivgoulis G, y col. Diagnostic criteria and yield or real-time transcranial Doppler monitoring of intra-arterial reperfusion procedures. Stroke 41(4):695-9, 2010.
20. Alexandrov AV, Tsivgoulis G, Rubiera M, y col. for the TUCSON Investigator. End-diastolic velocity increase predicts recanalizzation and neurological improvement inpatients with ischemic stroke with proximal arterial occlusions receiving reperfusion therapies. Stroke 41(5):948-52, 2010.
21. Eggers J, Pade O, Rogge A, Schreiber SJ, Valdueza JM. Transcranial color-coded sonography successfully visualizes all intracranial parts of the internal carotid artery using the combined transtemporal axial and coronal approach. AJNR Am J Neuroradiol 30(8):1589-1593, 2009.
22. Sallustio F, Kern R, Günther M, y col. Assessment of intracranial collateral flow by using dynamic arterial spin labeling MRA and transcranial color-coded duplex ultrasound. Stroke 39: 1894-1897, 2008.
23. Postert T, Braun B, Meves S, y col. Contrast-enhanced transcranial color-coded sonography in acute hemispheric brain infarction. Stroke 30:1819-1826, 1999.
24. Baumgartner RW, Heinrich P, Mattle P, Schroth G. Assessment of = 50% and < 50% intracranial stenoses by transcranial color-coded duplex sonography. Stroke 30:87-92, 1999.
25. Kunz A, Hahn G, Mucha D, y col. Echo-enhanced transcranial color-coded duplex sonography in the diagnosis of cerebovascular events: a validation study. AJNR 27:122-127, 2006.
26. Gerriets T, Postert T, Goertler M, y col. DIAS I: duplex-sonographic assessment of the cerebrovascular status in acute stroke: a useful tool for future stroke trials. Stroke 31:2342-2345, 2000.
27. Gerriets T, Goertler M, Stolz E, y col. Feasibility and validity of transcranial duplex sonography in patients with acute stroke. J Neurol Neurosurg Psychiatry 73:17-20, 2002.
28. Nedelmann M, Stolz E, Gerriets T, y col. for the TCCS consensus group. Consensus recommendations for transcranial color-coded duplex sonography for the assessment of intracranial arteries in clinical trials on acute stroke. Stroke 40:3238-3244, 2009.
29. Molina CA, Ribo M, Rubiera M, y col. Microbubble administration accelerates clot lysis during continuous 2-MHz ultrasound monitoring in stroke patients treated with intravenous tissue plasminogen activator. Stroke 37:425-9, 2000.
30. Molina CA, Barreto AD, Tsivgoulis G, y col. Transcranial ultrasound in clinica sonothrombolysis (TUCSON) trial. Ann Neurol 66(1):28-38, 2009.
31. Eggers J. Acute stroke: therapeutic transcranial color duplex sonography. Front Neurol Neurosci 21:162-70, 2006.
32. Gerriets T, Stolz E, König S, y col. Sonographic monitoring of midline shift in space-occupying stroke: an early outcome predictor. Stroke 32:442-447, 2001.
33. Seidel G, Cangür H, Albers T, Burgemeister A, Meyer-Wiethe K. Sonographic evaluation of hemorrhagic transformation and arterial recanalization in acute hemispheric ischemic stroke. Stroke 40:119-123, 2009.
34. Pérez ES, Delgado-Mederos R, Rubiera M, y col. Transcranial dúplex sonography for monitoring hyperacute intracerebral hemorrage. Stroke 40(3):987-990, 2009.
35. Gronholdt ML, Nordestgaard BG, Wiebe BM, y col. Echo-lucency of computerized ultrasound images of carotid atherosclerotic plaques are associated with increased levels of triglyceride-rich lipoproteins as well as increased plaque lipid content. Circulation 97:34-40, 1998.
36. Mathiesen EB, Bonaa KH, Joakimsen O. Echolucent plaques are associated with high risk of ischemic cerebrovascular events in carotid stenosis: the Tromso Study. Circulation 103:2171-2175, 2001.
37. Ohki T, Marin ML, Lyon RT, y col. Ex vivo human carotid artery bifurcation stenting: correlation of lesion characteristics with embolic potential. J Vasc Surg 27:463-471, 1998.
38. Tegos TJ, Sabetai MM, Nicolaides AN, y col. Correlates of embolic events detected by means of transcranial Doppler in patients with carotid atheroma. J Vasc Surg 33:131-138, 2001.
39. Henry M, Henry I, Klonaris C, y col. Benefits of cerebral protection during carotid stenting with the PercuSurge GuardWire system: midterm results. J Endovasc Ther 9:1-13, 2002.
40. Sztajzel R, Momjian-Mayor I, Comelli M, Momjian S. Correlation of cerebrovascular symptoms and microembolic signals with the stratified gray-scale median analysis and color mapping of the carotid plaque. Stroke 37:824-829, 2006.
41. Ruiz-Ares G, Fuentes B, Martínez-Sánchez P, Martínez-Martínez M, Díez-Tejedor E. Utility of the assessment of echogenicity in identification of symptomatic carotid artery atheroma plaques in ischaemic stroke patients. Cerbrovasc Dis 2011. In press.
42. Martínez-Sánchez P, Fernández-Domínguez J, Ruiz-Ares G, Fuentes B, Alexandrov AV, Díez-Tejedor E. Changes in carotid plaque echogenicity with time since the stroke onset: the UNPACK study. Stroke 41:e479, 2010.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



