|
Coautor
Brian Stephen Eley*
MBChB, FCP(Paeds), University of Cape Town, Ciudad del Cabo, Sudáfrica*
|
|
Recepción del artículo: 4 de octubre, 2010
|
|
Aprobación: 25 de marzo, 2011
|
 Conclusión breve
Conclusión breve
La inmunización de los niños VIH positivos es un campo de rápida evolución dada la mayor disponibilidad actual de la terapia antirretroviral. Para los países con recursos limitados se postula la creación de normativas de revacunación de rutina sin una pesquisa previa de anticuerpos.
 Resumen
Resumen
La inmunización de los niños VIH positivos es un campo de rápida evolución ya que la terapia antirretroviral (TAR) se encuentra más fácilmente disponible en los países en vías de desarrollo. Se ha descrito adecuadamente que los pacientes infectados por el VIH presentan respuestas inmunogénicas subóptimas frente a las vacunas pediátricas de rutina. Este artículo es una revisión de la bibliografía publicada en los últimos 10 años acerca de la inmunización de los niños que reciben TAR, con énfasis específico en las reinmunizaciones. La revacunación es claramente necesaria, pero no se han establecido con claridad los métodos óptimos. Existen también dos grupos diferentes de niños a considerar: los que iniciaron la TAR durante la primera infancia, cuando se administran las primeras series de vacunas, y aquellos que inician la TAR después del primer año de vida. Las investigaciones recientes sugieren que el inicio temprano de la TAR durante la infancia preserva la función de los linfocitos B y la memoria de la respuesta a las vacunas, lo que resulta en protección prolongada. No se definió la necesidad de las dosis de refuerzo después de la inmunización primaria en estos niños. Aquellos que iniciaron la TAR después del primer año de vida requieren repetir las series de vacunas iniciales o múltiples dosis de refuerzo debido a deficiencias inmunitarias funcionales. La reinmunización dirigida sobre la base de la cuantificación de los títulos de anticuerpos, de los análisis de la proliferación de linfocitos, o ambos, no es posible en países con recursos limitados. En estos contextos, deberían proponerse normativas de reinmunización de rutina sin una pesquisa de laboratorio previa.
 Palabras clave
Palabras clave
vacunación, niños VIH positivos, terapia antirretroviral
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/117769
Especialidades
 Principal: Infectología, Pediatría,
Principal: Infectología, Pediatría,
 Relacionadas: Atención Primaria, Bioquímica, Diagnóstico por Laboratorio, Farmacología, Inmunología, Medicina Familiar, Medicina Farmacéutica, Salud Pública,
Relacionadas: Atención Primaria, Bioquímica, Diagnóstico por Laboratorio, Farmacología, Inmunología, Medicina Familiar, Medicina Farmacéutica, Salud Pública,
 Enviar correspondencia a:
Enviar correspondencia a:
Reené Naidoo, University of Cape Town Red Cross War Memorial Children's Hospital
Paediatric Infectious Diseases Unit, Ciudad del Cabo, Sudáfrica
Immunizing HIV-Infected Children after Immune Reconstitution with Antiretroviral Therapy
 Abstract
Abstract
Immunization in HIV-infected children is a rapidly evolving field as antiretroviral therapy (ART) becomes more freely available in developing countries. It has been well described that HIV-infected individuals have suboptimal immunogenic responses to routine childhood vaccines. This article reviews the published literature over the past 10 years on immunization in children on ART focusing specifically on re-immunization. Revaccination is clearly necessary but optimal methods have not been clearly established. There are also two distinct groups of children to consider: infants started on ART during early infancy when their primary vaccine series is being administered and those who initiate ART beyond the age of 1 year. Recent research suggests that early ART initiation during infancy preserves B cell function and memory response to vaccines, resulting in prolonged protection. Whether booster vaccine doses are needed after primary immunization in these children remains unclear. Children, initiated on ART after the age of 1 year require repeat of the primary vaccine series or multiple booster doses due to functional immune deficits. Targeted re-immunization based on antibody titre quantification and, or lymphocyte proliferation assays is not possible in resource-limited countries. In these settings, routine re-immunization guidelines without prior laboratory screening should be developed.
 Key words
Key words
immunization, HIV-infected children, antiretroviral therapy
ESTRATEGIAS DE VACUNACIÓN EN NIÑOS VIH POSITIVOS
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
Introducción
La inmunización es un componente vital de la prevención de las enfermedades en los niños infectados por el virus de la inmunodeficiencia humana (VIH). En las recomendaciones de la Organización Mundial de la Salud (2003) se propone que todos los niños infectados por el VIH deberían vacunarse de acuerdo con las normativas nacionales de inmunizaciones de cada país en particular, con la excepción de la vacuna de la fiebre amarilla en niños VIH positivos sintomáticos y de la vacuna BCG (bacilo de Calmette-Guérin) en todos los niños VIH positivos.1
Se publicó una gran cantidad de bibliografía acerca de al inmunización de los niños VIH positivos sin antecedentes de terapia antirretroviral (TAR). La respuesta inmunológica a las distintas vacunas en estos niños es inferior en comparación a la población general de niños seronegativos para el VIH, y muy pocos de ellos desarrollan una respuesta de anticuerpos protectores.1-4 Además, las medias geométricas de los títulos de anticuerpos protectores son más bajas, con una peor calidad de los anticuerpos y pérdida de la inmunidad protectora en corto tiempo. Esto ocurre por una desregulación del sistema inmune la cual tiene lugar tempranamente durante la historia natural de la enfermedad por VIH. Aun la supresión completa de la viremia y el restablecimiento del recuento de linfocitos T CD4+ con la TAR no resuelve las deficiencias funcionales de la inmunidad.2 En contextos con recursos limitados, la mayoría de los niños VIH positivos inician la TAR en la etapa tardía de la enfermedad, cuando los linfocitos B de memoria están alterados. En las normativas revisadas de tratamiento de la OMS se recomienda la TAR universal para todos los niños VIH positivos. Las investigaciones recientes sugieren que el inicio precoz de la TAR permite el normal desarrollo del compartimiento de linfocitos B y evita la disminución de las respuestas humorales.6 Con el incremento del número de niños en tratamiento, se requieren urgentes normativas acerca de la revacunación de los niños que reciben TAR.
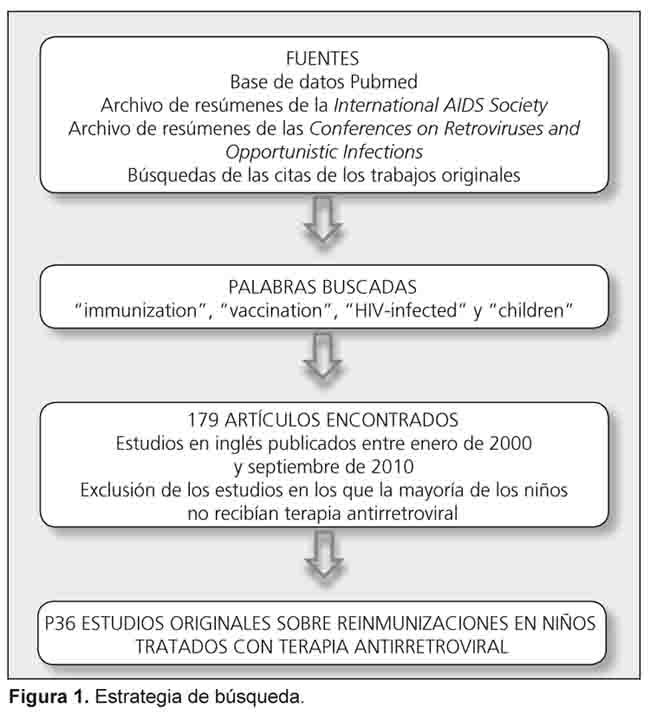
El objetivo de esta revisión fue evaluar los datos publicados acerca de la inmunización de los niños VIH positivos que reciben TAR, y la elaboración de recomendaciones, especialmente para aquellos pacientes de áreas con recursos limitados. La estrategia de búsqueda empleada en esta revisión se describe en la Figura 1. Se accedió a los artículos adicionales por medio de las citas de los trabajos originales.
Vacunas a gérmenes inactivados
Vacuna contra la hepatitis B
La vacuna contra la hepatitis B ha sido extensamente estudiada en niños VIH positivos que reciben TAR. Cuatro estudios evaluaron la respuesta de anticuerpos con la TAR por sí sola y demostraron que el 55% al 87% de los niños no alcanzaban niveles protectores por al menos 4 años después de recibir la serie inicial de vacunación, a pesar de la reconstitución inmune.7-11 Los valores más elevados de linfocitos T CD4+ en el nadir se asociaron con niveles adecuados de anticuerpos.9
Dos estudios analizaron la administración repetida de la serie inicial de vacunas en niños previamente inmunizados, pero sin títulos adecuados de anticuerpos. En una cohorte tailandesa se observó que el 17%, el 82% y el 92% de los niños lograron la seroconversión después de la primera, la segunda o la última dosis, respectivamente, mientras que los niños de Tanzania experimentaron una tasa de seroconversión del 70% cinco meses después de la repetición de la serie inicial de vacunas.8,11 Los factores predictivos de la respuesta de anticuerpos difirieron. En el estudio tailandés se observó que la alta carga viral se asociaba con peores resultados, mientras que mediante el ensayo tanzano se verificó que el porcentaje de linfocitos T CD4+ en el momento de la vacunación era una variable predictiva independiente de seroconversión.
En los estudios en los que se investigó la eficacia del refuerzo de vacunación se informó una seroconversión del 46% dos meses después de un refuerzo, en Estados Unidos.9 Los niños con un nadir de linfocitos CD4+ mayor del 25% y un recuento mayor del 25% en el momento de la vacunación tuvieron la mejor respuesta, con una seroconversión del 64%. En Brasil, sólo el 33% de los niños respondieron a un refuerzo único a pesar del uso de una doble dosis de vacuna y el 66% requirió 6 refuerzos antes de la seroconversión.10
Vacuna contra la difteria, el tétanos y Bacillus pertussis (acelular)
Los estudios de inmunización con la vacuna contra la difteria, el tétanos y la tos ferina [B. pertussis acelular (DTaP)] produjeron resultados variables. En un grupo estadounidense que recibió TAR durante una mediana de 5 años, sólo el 38% tenía anticuerpos adecuados contra el tétanos al menos 5 años después de la primera serie de vacunas en la infancia.12 Por el contrario, en una cohorte de Kenia mucho más numerosa se observó que el 78% de los niños que recibieron una serie inicial de vacunas contra el tétanos dentro de los últimos 5 años tenían niveles de anticuerpos adecuados antes de la TAR; el 19% perdieron esos anticuerpos 6 meses después del comienzo de la TAR, y un refuerzo único en aquellos con niveles subóptimos de anticuerpos provocó seroconversión en el 75%.13 De la misma manera, dos estudios estadounidenses describen tasas de seroconversión de 92% y 74% después de un refuerzo único.12,14 No se observaron asociaciones entre la respuesta a la vacunación, el porcentaje de los linfocitos T CD4+ en el nadir, el porcentaje de linfocitos T CD4+ en el momento del estudio o la carga viral. La duración de los anticuerpos contra el tétanos, de todos modos, es incierta. Rosenblatt y col. demostraron que sólo el 38% de los niños inmunológicamente estables permanecían protegidos 8 meses después del refuerzo con vacuna antitetánica. Como contrapartida, Ching y col. informaron que el 85% de los niños vacunados conservaban inmunidad humoral protectora 12 meses después.12,14 Ambos estudios, sin embargo, se efectuaron con una pequeña cantidad de pacientes y se requiere mayor investigación para evaluar la extensión de la declinación de la inmunidad.
Todos los ensayos en los que se investigó la respuesta a la vacuna contra la tos ferina en niños VIH positivos se efectuaron en países industrializados con el uso de la vacuna acelular. Esto limita la aplicabilidad en los contextos con recursos limitados, en los cuales se utiliza habitualmente la vacuna contra la tos ferina con células completas. En un estudio con vacuna acelular se demostró que un refuerzo único genera una buena respuesta inicial, pero los anticuerpos decaen rápidamente dentro de los 6 a 12 meses.15 El recuento elevado de linfocitos T CD4+ y la baja carga viral al momento de la vacuna de refuerzo fueron factores predictivos de una mejor respuesta a la vacunación. No se evaluó la revacunación para la difteria en niños que reciben TAR.
Tabla 1
Vacuna contra Haemophilus influenzae tipo B
Sin una vacunación de refuerzo, la reconstitución inmune con la TAR por sí sola no mejora la inmunidad contra Haemophylus influenzae tipo B (Hib). En una cohorte de Estados Unidos, sólo el 24% de los niños tratados con TAR de más de 5 años tenían valores adecuados de anticuerpos, en comparación con el 85% de los pacientes no infectados.16 Un refuerzo único en aquellos con niveles no adecuados de anticuerpos indujo inmunidad en un 42%, mientras que dos dosis de refuerzo se asociaron con una seroprotección del 83%. Los niños tailandeses de más de 2 años que no habían recibido la serie inicial de vacunación alcanzaron una respuesta protectora del 66% con una dosis de vacuna. La seroconversión se asoció de forma inversa con la carga viral para VIH.17 De manera similar, en una cohorte griega se demostró una respuesta protectora del 89% dentro del primer mes de un refuerzo único, aunque la media geométrica de los títulos fue significativamente menor que la de los sujetos de control.18 La respuesta inmune de memoria ante un segundo refuerzo no produjo cambios significativos en la media de los títulos de anticuerpos, aunque permanecían en niveles protectores 18 meses después. Estos hallazgos sugieren que los niños VIH positivos de más de 2 años podrían beneficiarse con al menos una dosis de refuerzo de la vacuna contra Hib, aunque la duración de la respuesta requiere mayor investigación.
Vacuna conjugada antineumocócica
Los niños VIH positivos conllevan una alta proporción de enfermedad por neumococo en todo el mundo y presentan un riesgo 42 veces mayor de enfermedad neumocócica invasiva en comparación con los no infectados.19 Un esquema inicial de tres dosis de una vacuna conjugada antineumocócica (PCV) 9-valente fue eficaz en un 65% en evitar la enfermedad neumocócica invasiva por esos serotipos durante un período de 2 años en los niños VIH positivos que no recibían TAR. Sin embargo, la eficacia se redujo significativamente al 39% seis años después, con el 24% de la cohorte en tratamiento con TAR.20-21
El 92% de los niños que iniciaron tenpranamente la TAR en el momento de la inmunización inicial contra el neumococo tenían niveles adecuados de anticuerpos, de manera similar a los niños VIH positivos no tratados con TAR, alrededor de 3 a 6 semanas después de completar la serie de vacunación.22 Sin embargo, aquellos que recibían TAR tenían mejor respuesta funcional de anticuerpos medida por medio de la actividad opsonofagocítica. Se percibieron buenas respuestas inmunitarias de memoria con linfocitos T CD4+ > 25% en el momento del refuerzo de la vacunación. Costa y col. demostraron que el 95% de los niños brasileros presentaban niveles protectores de anticuerpos después de 2 dosis de refuerzo separadas por 2 meses.23 Abzug y col. observaron respuestas perdurables durante 6 meses en 76% a 96% de los niños de más de 2 años, con seroconversión después de dos series de dosis de vacuna PCV7, sucedidas de un refuerzo de vacuna contra polisacáridos neumocócicos (PPV23) 2 meses después.24 El recuento de linfocitos T CD4+ en el momento de la inmunización, la carga viral para VIH y el estrato inmunológico de los Centers for Disease Control (CDC) fueron adecuados factores predictivos de la respuesta a la vacunación, mientras que la indicación de PPV23 antes del ingreso al estudio no resultó una buena variable predictiva. Estos estudios sugieren que los niños VIH positivos que reciben TAR se benefician con una serie de al menos dos vacunaciones de refuerzo, mientras que la supresión viral y un elevado porcentaje de linfocitos T CD4+ maximizan la respuesta.
Vacuna contra la influenza
Si las prioridades en salud de los países en desarrollo permiten la vacunación contra la influenza en los grupos de alto riesgo, la OMS recomienda la vacuna contra la influenza con virus inactivados en los niños VIH positivos.25 Una dosis única de vacuna trivalente virosomal indujo niveles protectores de anticuerpos contra las tres cepas virales en 52% a 74% de los niños italianos VIH positivos que recibían TAR, mientras que en un estudio colombiano en el cual se utilizó vacuna con virus inactivos, la seroconversión fue de 44% a 69%.26-27 La supresión viral no modificó la respuesta de anticuerpos en ninguno de los ensayos. No pudieron establecerse los efectos del recuento de linfocitos T CD4+, ya que la mayor parte de los niños en ambos estudios mantenían una función inmunitaria preservada. En una cohorte italiana en la que se investigó la duración de la inmunidad, se demostró que el 75% al 79% de los niños estaban protegidos un mes después de la vacunación y que 54% a 75% aun conservaban inmunidad 6 meses después.28
Se observaron resultados contradictorios en dos estudios en los cuales se evaluó la eficacia de la vacuna. Entre los niños italianos tratados con TAR con altos niveles de anticuerpos (73% a 88%), como resultado de haber sido vacunados en la temporada anterior, todos alcanzaron un 100% de seroconversión con la vacuna virosomal dentro del primer mes.29 Sólo el 6% presentó influenza estacional, pero todos ellos se caracterizaron por una evolución benigna sin necesidad de internación. Por el contrario, en un estudio controlado y aleatorizado, en Sudáfrica, se observó que la vacuna contra la influenza con virus inactivos era sólo moderadamente inmunogénica, con una eficacia muy baja, de sólo el 7%.30 En este estudio, el 92% de los niños recibían TAR con una mediana de linfocitos T CD4+ de 33%. La vacuna con virus inactivados fue segura y no desencadenó un incremento de la carga viral para VIH. Estos ensayos demostraron que, aunque la vacuna contra la influenza puede ser inmunogénica en sujetos tratados con TAR y tiene efectos aditivos en relación con la vacunación estacional anual, se necesitan más estudios para evaluar su eficacia.
Vacuna contra el virus del papiloma humano
La seguridad y la inmunogenicidad de la vacuna tetravalente contra el virus del papiloma humano se evaluaron recientemente en un estudio controlado y aleatorizado con un grupo de 126 niñas infectadas por VIH que recibían TAR, de entre 7 y 12 años. La vacuna provocó la seroconversión para los cuatro antígenos en más del 96% de la cohorte y no se describieron efectos adversos.31
Vacuna contra la hepatitis A
Dado que la hepatitis A es una enfermedad endémica y autolimitada en muchos países en desarrollo, la vacuna no es una prioridad en contextos de bajos recursos. Se describió que resulta beneficiosa en pacientes de alto riesgo en áreas de baja endemia. En los niños estadounidenses que reciben TAR, una serie inicial de dos dosis indujo la seroconversión en el 97% de los pacientes con linfocitos T CD4+ > 20%, aunque en el 47% se trataba de niveles positivos bajos.32 La carga viral indetectable para VIH se asoció con títulos de anticuerpos más elevados. Siberry y col. informaron una respuesta de anticuerpos del 85%, también después de la administración de una serie inicial de dos dosis; el porcentaje de linfocitos T CD4+ y la supresión de la carga viral fueron sendos factores predictivos para la seropositividad contra el virus de la hepatitis A.33
Vacuna antimeningocócica
En un reciente estudio se evaluó la seguridad y la inmunogenicidad de la vacuna antimeningocócica conjugada tetravalente con polisacáridos en niños VIH positivos, de los cuales el 81% recibía TAR.34 Se observó que la vacuna era segura e inducía anticuerpos protectores en un intervalo de 52% a 73% para los cuatro diferentes serogrupos. El bajo porcentaje de linfocitos T CD4+, la carga viral elevada y un estadio avanzado de la enfermedad se asociaron con menor respuesta de anticuerpos.
Vacuna contra la encefalitis japonesa
En dos estudios tailandeses se evaluó esta vacuna en niños tratados con TAR. En aquellos que no tenían anticuerpos protectores después de las dosis iniciales de la infancia, la revacunación con dos dosis se asoció con protección en el 88% de los niños.35 Recientemente, el mismo grupo de investigadores demostró que el 94% de los pacientes pediátricos que comenzaron TAR en forma temprana antes de la serie inicial de vacunas tenían inmunidad 3 meses después.36
Tabla 2
Vacunas con organismos vivos
Sarampión, paperas y rubéola (MMR)
La inmunidad contra el sarampión se atenúa rápidamente en los niños VIH positivos que no reciben TAR.37 La reconstitución inmunitaria no modifica esta declinación, como se demostró en Kenia y Tailandia, donde sólo el 42% de los niños tenía títulos protectores después de 6 meses de recibir TAR.13,38 Además, en un estudio estadounidense se señaló que el 5% de los niños con TAR estable tenían anticuerpos basales contra el sarampión, mientras que el 40% de los integrantes de una cohorte holandesa que tenían anticuerpos antes del comienzo de la TAR perdieron esos anticuerpos específicos después de su inicio.39,40 En los ensayos sobre revacunación se demostró una seroconversión del 64% después de un refuerzo de MMR, en Estados Unidos, y una seroconversión del 78% tras un refuerzo de vacuna antisarampionosa, en Kenia.13,41 Melvin y col. informaron una seroconversión del 83% después de un mes de la revacunación, con un mantenimiento de anticuerpos contra el sarampión del 73% un año más tarde.39 Asimismo, en una cohorte de Tailandia se demostró una seroconversión del 90% un mes después de una dosis única de MMR y la protección se mantuvo en niveles razonablemente elevados del 85% a los tres años de la vacunación.42,43 El nadir y el recuento de los linfocitos T CD4+ al momento de la inmunización, así como la carga viral y la duración de la TAR, no modificaron significativamente la respuesta a la reinmunización.13,42 Se destaca que los niños que fueron revacunados sólo una vez alcanzaron niveles de linfocitos T CD4+ > 15%, de acuerdo con las normativas de la OMS. En un estudio se evaluaron los niveles de anticuerpos contra el sarampión a largo plazo en 15 niños que iniciaron precozmente la TAR antes de la vacunación inicial. Sólo el 25% de los niños con un estadio B o C de la clasificación de los CDC tenían niveles protectores de anticuerpos a los 2 años de edad, en comparación con el 90% de aquellos con un estadio N o A.44
El uso de la vacuna MMR en lugar de la antisarampionosa aislada brinda protección adicional contra las paperas y la rubéola en los niños VIH positivos. La inmunización contra la rubéola indujo excelente inmunidad en una cohorte brasilera que inició la TAR a una mediana de edad de 3.8 meses.45 En los niños con una inmunidad de la categoría 1 de los CDC se demostró una seroconversión del 100%, mientras que en aquellos con una categoría 2 o 3 de los CDC se observó una seroconversión del 62%. En los estudios tailandeses se mostraron resultados similares, con una seroconversión del 100% en el primer mes, del 94% a los 6 meses y del 79% a los 3 años.42,43 Se efectuó un menor número de ensayos en relación con las paperas. En los estudios de Tailandia se informó una respuesta de anticuerpos contra las paperas del 78% con el refuerzo de vacunación en niños tratados con TAR, que se redujo al 61% después de 3 años.42,43
Vacuna antipoliomielítica
En la mayoría de los países en desarrollo, la vacuna antipoliomielítica oral con virus vivos (VAPO) se utiliza aún rutinariamente para la inmunización de los niños VIH positivos. No se dispone de investigaciones acerca de la seguridad e inmunogenicidad de la revacunación de los niños tratados con TAR. Se informó la aparición de poliomielitis paralítica asociada con la vacunación después de la administración de VAPO en 2 niños VIH positivos, pero ninguno de ellos recibía TAR al momento de la vacunación.47,48
Vacuna contra la varicela
En los estudios en los que se evaluó la vacuna contra la varicela se demostró una respuesta moderada de anticuerpos en niños con TAR estable. Levin y col. demostraron una seroconversión del 60% después de dos dosis de vacuna en niños con linfocitos T CD4+ > 25% y subsecuentemente observaron que aquellos con linfocitos T CD4+ > 15% tenían resultados comparables (59% a 72%).49,50 Como consecuencia, el Advisory Committee on Inmunization Practices recomendó la utilización de la vacuna sólo en los niños con linfocitos T CD4+ > 15%.51 También en un estudio holandés se señaló una respuesta de anticuerpos del 60% después de un esquema de vacunación con dos dosis, mientras que en una cohorte estadounidense se demostró una seroconversión del 67% tras una dosis de vacuna.52,53 Después de un año, sólo el 33% conservaba anticuerpos adecuados, si bien el 90% presentaba una respuesta positiva de proliferación de linfocitos T.53 El único evento adverso informado en un niño VIH positivo sin TAR fue un caso de neumonitis varicelosa después de la inmunización.54 En un estudio de cohortes en el que se evaluó la eficacia de la vacuna, se observó que una dosis de vacunación en niños que recibían TAR se asoció con una eficacia del 82% para evitar la varicela y del 100% para evitar el herpes zóster por un período de 4 años.55 El comienzo de la TRA por sí solo no modificó la tasa de episodios de herpes zóster en los niños no vacunados, pero el índice de infecciones se redujo en un 63% después de la vacunación. Esto sugiere que la vacuna contra la varicela es una incorporación útil al calendario de vacunación en los niños VIH positivos con linfocitos T CD4+ > 15% después de la reconstitución inmune.
Vacuna contra el rotavirus
A partir de 2009, la OMS recomendó la vacuna contra el rotavirus para todos los lactantes.56 Se dispone de escasos datos en relación con la respuesta a esta vacuna en niños VIH positivos. En la información preliminar sobre seguridad de un estudio aleatorizado de fase II que incluyó niños infectados por VIH no se encontraron efectos adversos significativos.57 Se requieren ensayos con mayor cantidad de participantes con niños VIH positivos para determinar la seguridad y eficacia de esta vacuna.
Vacuna contra la fiebre amarilla
En la actualidad no se recomienda el uso de la vacuna con virus vivos atenuados contra la fiebre amarilla en sujetos VIH positivos, dado el riesgo de encefalitis posvacunación.1 En un estudio con adultos con un 40% de individuos que recibían TAR con un recuento de linfocitos T CD4+ > 200 células/mm3 se demostró una seroconversión del 83% después de la vacunación, sin efectos adversos graves.58 No se dispone en la actualidad de datos acerca de la seguridad y la inmunogenicidad de la vacuna en niños tratados con TAR.
Vacuna con el bacilo de Calmette-Guérin
La OMS recomendó en 2007 que la infección por VIH es una contraindicación para recibir la vacuna con el bacilo de Calmette-Guérin (BCG). Los niños VIH positivos inmunizados con BCG al nacer tienen un mayor riesgo de síndrome inflamatorio de reconstitución inmune (SIRI-BCG) al iniciar la TAR.60-63 Sin embargo, el comienzo temprano de la TAR se asoció con una reducción de 3 veces en el riesgo de SIRI-BCG (del 15.7% al 5.2%) en comparación con el comienzo tardío de la TAR.64
Discusión
La inmunización contra las enfermedades prevenibles frecuentes en la niñez es crítica en los niños VIH positivos. En la mayoría de los estudios se demostró de manera sistemática que el inicio de la TAR no es suficiente para reestablecer la integridad de la respuesta humoral en ausencia de revacunación. Se emplearon diferentes estrategias para investigar si se requiere sólo refuerzos o bien la repetición de la serie inicial para optimizar la inmunidad. En relación con la vacuna contra la hepatitis B, parece beneficioso repetir la inmunización inicial, mientras que una o dos dosis de refuerzo de las vacunas antitetánica, tos ferina acelular, MMR, antineumocócica y contra Hib brindan niveles razonables de anticuerpos. También se investigó la duración de la protección otorgada por la reinmunización para evaluar la declinación de la inmunidad en niños que reciben TAR. Las vacunas contra el tétanos, difteria, Hib y neumococo parece brindar protección por 6 a 18 meses, mientras que las vacunas con agentes vivos (MMR y contra la varicela) se relacionan con una duración más prolongada de la protección (3 a 4 años). Se desconoce el motivo de este hallazgo, pero las vacunas con virus vivos sólo se administraron a niños con linfocitos T CD4+ > 15%. Se destaca que la mayoría de los estudios incluidos en esta revisión se centraron en la inmunogenicidad de las vacunas. En pocos ensayos se evaluó la eficacia clínica posterior a la revacunación. Asimismo, en 15 de los 36 estudios sólo se revacunaron los niños con niveles subóptimos de anticuerpos.
Otra inquietud en contextos con limitaciones en los recursos es el modo de implementar la revacunación en los programas de TAR a gran escala. En el mundo desarrollado, la reinmunización se lleva a cabo habitualmente en niños con niveles subóptimos de anticuerpos. En los países en desarrollo, la determinación de anticuerpos es costosa y poco práctica. Por lo tanto, debería considerarse de forma acentuada la revacunación de rutina. Se requiere mayor investigación para estimar el momento óptimo para la reinmunización, porque los efectos del porcentaje de linfocitos T CD4+, la carga viral para VIH y el estadio clínico de la infección sobre la respuesta a la vacuna no son siempre confiables, aun entre estudios con las mismas vacunas.
Sobre la base de la bibliografía actual, es difícil formular recomendaciones claras para la revacunación de los niños que reciben TAR en áreas con recursos limitados. En las futuras investigaciones deben considerarse dos campos importantes. En primer lugar, se requieren más estudios de los efectos del inicio temprano de la TAR sobre la perdurabilidad de la respuesta humoral posterior a la administración de la serie inicial de vacunas. En los pocos ensayos en los que se evaluó el efecto de la TAR temprana se demostró que, a corto plazo, estos niños responden a la vacunación tan bien como aquellos que no están infectados, debido a que la función de los linfocitos B está preservada.6 Se desconoce para estos niños tanto la necesidad de refuerzos como el momento adecuado para aplicar esas dosis. En segundo lugar, no se conoce la eficacia o efectividad de la revacunación de niños de mayor edad en quienes la TAR se inició en forma tardía. En consecuencia, debería optimizarse la durabilidad de la protección posterior a la revacunación, así como el momento y la frecuencia de las dosis subsiguientes de refuerzo.
 Bibliografía del artículo
Bibliografía del artículo
1. Moss WJ, Clements CJ, Halsey NA. Immunization of children at risk of infection with human immunodeficiency virus. Bulletin of the World Health Organization 81:61-70, 2003.
2. Abzug M. Vaccination in the immunocompromised child. Pediatr Infect Dis J 28:233-36, 2009.
3. Eley BS. Immunization in patients with HIV infection. Drugs 68:1473-81, 2008.
4. Obaro SK, Pugatch D, Luzuriaga K. Immunogenicity and efficacy of childhood vaccines in HIV-1 infected children. Lancet Infect Dis 4:510-18, 2004.
5. Madhi SA, Kuwanda L, Cutland C, Holm A, Käyhty H, Klugman KP. Quantitative and qualitative antibody response to pneumococcal conjugate vaccine among African human immunodeficiency virus-infected and uninfected children. Pediatr Infect Dis J 24:410-16, 2005.
6. Pensieroso S, Cagigi A, Palma P et al. Timing of HAART defines the integrity of memory B cells and the longevity of humoral responses in HIV-1 vertically infected children. PNAS 106:7939-44, 2009.
7. Siriaksorn S, Puthanakit T, Sirisanthana T, Sirisanthana, V. Prevalence of protective antibody against hepatitis B virus in HIV-infected children with immune recovery after highly active antiretroviral therapy. Vaccine 24:3095-99, 2006.
8. Lao-Araya M, Puthanakit T, Aurpibul L, Sirisanthana T, Sirisanthana V. Antibody response to hepatitis B re-vaccination in HIV-infected children with immune recovery on highly active antiretroviral therapy. Vaccine 25:5324-29, 2007.
9. Abzug M, Warshaw M, Rosenblatt HM, et al. Immunogenicity and immunologic memory after Hepatitis B virus booster vaccination in HIV-infected children receiving highly active antiretroviral therapy. J Infect Dis 200:935-46, 2009.
10. Pessoa SD, Miyamoto M, Ono E, et al. Persistence of vaccine immunity against hepatitis B virus and response to revaccination in vertically HIV-infected adolescents on HAART. Vaccine 28:1606-12, 2010.
11. Pippi F, Bracciale L, Stolzuoli L, et al. Serological response to hepatitis B vaccine in HIV-infected children in Tanzania. HIV Medicine 9:519-25, 2008.
12. Ching N, Deville JG, Nielsen KA, Ank B et al. Cellular and humoral immune response to a tetanus toxoid booster in perinatally HIV-infected children and adolescents receiving highly active antiretroviral therapy. Eur J Pediatr 166:51-56, 2007.
13. Farquhar C, Wamalwa D, Selig S, et al. Immune responses to measles and tetanus vaccines among Kenyan human immunodeficiency virus type 1 (HIV-1)-infected children pre- and post-highly active antiretroviral therapy and re-vaccination. Pediatr Infect Dis J 28:295-99, 2009.
14. Rosenblatt HM, Song LY, Nachman SA, et al. Tetanus immunity after diphtheria, tetanus toxoids and acellular pertussis vaccination in children with clinically stable HIV infection. J Allergy Clin Immunol 116:698-703, 2005.
15. Abzug MJ, Song LY, Fenton T, et al. Pertussis booster vaccination in HIV-infected children receiving highly active antiretroviral therapy. Pediatrics 120:e1190-1202, 2007.
16. Choudhury SA, Mishreki NK. Subnormal immunity to Hemophilus influenzae type b (Hib) in previously vaccinated human immunodeficiency virus-infected children 59 months of age or older and response to booster doses of the conjugate vaccine. Clin Pediatr 43:831-35, 2004.
17. Chokephaibulkit K, Phongsamart W, Vanprapar N, Chotpitayasunondh T, Chearskul S. Catch-up vaccination against Haemophilus influenzae type b in human immunodeficiency virus-infected Thai children older than 2 years old. Vaccine 22:2018-22, 2004.
18. Spoulou VI, Tsoumas DL, Papaevangelou VG, Mostrou GI, Theodoridou MC. Haemophilus influenzae type b conjugate vaccine-induced immunological memory in symptomatic HIV-1 infected children. AIDS 17:1396-98, 2003.
19. Madhi SA, Petersen K, Madhi A, Wasas A, Klugman KP. Impact of human immunodeficiency virus type 1 on the disease spectrum of Streptococcus pneumoniae in South African children. Pediatr Infect Dis J 19:1141-47, 2000.
20. Klugman KP, Madhi SA, Huebner RE, Kohberger R, Mbelle N, Pierce N. A trial of a 9-valent pneumococcal conjugate vaccine in children with and those without HIV infection. NEJM 349:1341-48, 2003.
21. Madhi SA, Adrian P, Kuwanda L, et al. Long-term immunogenicity and efficacy of a 9-valent conjugate pneumococcal vaccine in human immunodeficient virus infected and non-infected children in the absence of a booster dose of vaccine. Vaccine 25:2451-57, 2007.
22. Madhi SA, Adrian P, Cotton MF, et al. Effect of HIV infection status and anti-retroviral treatment on quantitative and qualitative antibody responses to pneumococcal conjugate vaccine in infants. J Infect Dis 202:355-61, 2010.
23. Costa Ide C, Guilardi F, Kmiliauskis MA, Arslanian C, Baldacci ER. Evaluation of humoral response to heptavalent pneumococcal conjugate vaccine in HIV-infected children. Rev Saude Publica 42:844-50, 2008.
24. Abzug MJ, Pelton SI, Song LY, et al. Immunogenicity, safety and predictors of response after a pneumococcal conjugate and pneumococcal polysaccharide vaccine series in human immunodeficiency virus-infected children receiving highly active antiretroviral therapy. Pediatr Infect Dis J 25:920-25, 2006.
25) Influenza vaccine: WHO position paper. Weekly epidemiological record. 2005: Accessed 10/8/2010. www.who.int/immunization/wer8033influenza_August2005_position_paper.pdf.
26. Zuccotti GV, Zenga A, Durando P, et al. Immunogenicity and tolerability of a trivalent virosomal influenza vaccine in a cohort of HIV-infected children. J Int Med Res 32:492-99, 2004.
27. Montoya CJ, Toro MF, Aguirre C, et al. Abnormal humoral immune response to influenza vaccination in pediatric type-1 human immunodeficiency virus infected patients receiving highly active antiretroviral therapy. Mem Inst Oswaldo Cruz 102:501-8, 2007.
28. Viganò A, Zuccotti GV, Pacei M, et al. Humoral and cellular response to influenza vaccine in HIV-infected children with full viroimmunologic response to antiretroviral therapy. J Acquir Immune Defic Syndr 48:289-96, 2008.
29. Amendola A, Pariani E, Viganò A, et al. Influenza surveillance in a cohort of HIV-infected children and adolescents immunized against seasonal influenza. Vaccine 28:2700-4, 2010.
30. Violari A, Dittmer S, Cassim H, et al. Efficacy and immunogenicity if trivalent inactivated influenza vaccine (TIV) in HIV-infected children: a randomized, double blind, placebo-controlled trial. The XVIII International AIDS conference: Abstract no. MOPE0207.
31. Levin MJ, Moscicki AB, Song LY, et al. Safety and immunogenicity of a quadrivalent human papillomavirus (Types 6, 11, 16, and 18) vaccine in HIV-infected children 7 to 12 years old. J Acquir Immune Defic Syndr 2010 [Epub ahead of print].
32. Weinberg A, Gona P, Nachman SA, et al. Antibody response to hepatitis A virus vaccine in HIV-infected children with evidence of immunologic reconstitution while receiving highly active antiretroviral therapy. J Infect Dis 193:302-11. 2006.
33. Siberry GK, Coller RJ, Henkle E. Antibody response to hepatitis A immunization among human immunodeficiency virus-infected children and adolescents. Ped Infect Dis J 27:465-7, 2008.
34. Siberry GK, Williams PL, Lujan-Zilbermann J, et al. Phase I/II, open-label trial of safety and immunogenicity of meningococcal (Groups A, C, Y, and W-135) polysaccharide diphtheria toxoid conjugate vaccine in human immunodeficiency virus-infected adolescents. Ped Infect Dis J 29:391-6, 2010.
35. Puthanakit T, Aurpibul L, Yoksan S, Sirisanthana T, Sirisanthana V. Japanese encephalitis vaccination in HIV-infected children with immune recovery after highly active antiretroviral therapy. Vaccine 25:8257-61, 2007·
36. Chokephaibulkit K, Plipat N, Yoksan S, et al. A comparative study of the serological response to Japanese encephalitis vaccine in HIV-infected and uninfected Thai children. Vaccine 28:3563-6, 2010.
37. Moss, WJ, Scott S, Mugala N, et al. Immunogenicity of standard-titer measles vaccine in HIV-1 -infected and uninfected Zambian children: An observational study. J Infect Dis 196:347-55, 2007.
38. Aurpibul L, Puthanakit T, Siriaksorn S, Sirisanthana T, Sirisanthana V. Prevalence of protective antibody against measles in HIV-infected children with immune recovery after highly active antiretroviral therapy. HIV Medicine 7:467-70, 2006.
39. Melvin AJ, Mohan KM. Response to immunization with measles, tetanus and haemophilus influenzae type b vaccines in children who have human immunodeficiency virus type 1 infection and are treated with highly active antiretroviral therapy. Pediatrics 111:e641-44, 2003.
40. Bekker V, Scherpbier H, Pajkrt D, Jurriaans S, Zaaijer H, Kuijpers TW. Persistent humoral immune defect in highly active antiretroviral therapy-treated children with HIV-1 infection: Loss of specific antibodies against attenuated vaccine strains and natural viral infection. Pediatr 118:e315-322, 2006.
41. Berkelhamer S, Borock E, Elsen C, Englund J, Johnson D. Effect of highly active antiretroviral therapy on the serological response to additional measles vaccinations in human immunodeficiency virus-infected children. Clinical Infectious Diseases 32:1090-4, 2001.
42. Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Response to measles, mumps, and rubella Revaccination in HIV-infected children with immune recovery after highly active antiretroviral therapy. Clinical Infectious Diseases 45:637-42, 2007.
43 Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Persistence of measles, mumps and rubella protective antibodies 3 years after revaccination in HIV-infected children receiving antiretroviral therapy. Clinical Infectious Diseases 50:1415-18, 2010.
44. Pracanica A, Russo P, Zaccarelli-Filho R, et al. Response to primary immunization to tetanus, diphtheria, H. influenzae type b and measles in HIV-infected children on HAART. Oral abstract: 9th Conference on Retroviruses and Opportunistic Infections 2002.
45. Lima M, De Menzes Succi RC, Nunes Dos Santos AM, Weckx LY, De Moraes-Pinto MI. Rubella immunization in human immunodeficiency virus type 1-infected children. Pediatr Infect Dis J 23:604-7, 2004.
46. Tejiokem MC, Gouandjika I, Béniguel L, et al. HIV-infected children living in Central Africa have low persistence of antibodies to vaccines used in the expanded program on immunization. PLoS ONE 2:e1260, 2007.
47. Chitsike I, Van Furth R. Paralytic poliomyelitis associated with live oral poliomyelitis vaccine in child with HIV infection in Zimbabwe: case report. BMJ 318:841-3, 1999.
48. Ion-Nedelcu N, Dobrescu A, Strebel PM, Sutter RW. Vaccine-associated paralytic poliomyelitis and HIV infection. Lancet 343:51-2, 1994.
49. Levin MJ, Gershon AA, Weinberg A, et al. Immunization of HIV-infected children with varicella vaccine. J Pediatr 139:305-10, 2001.
50. Levin MJ, Gershon AA, Weinberg A, et al. Administration of live varicella vaccine to HIV-infected children with current or past significant depression of CD4+ T cells. J Infect Dis 194:247-55, 2006.
51. Centers for Disease Control and Prevention. Prevention of varicella: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 56(RR-4):1-40, 2007.
52. Bekker V, Westerlaken GHA, Scherpbier H, et al. Varicella vaccination in HIV-1-infected children after immune reconstitution. AIDS 20:2321-29, 2006.
53. Armenian SH, Han JY, Dunaway TM, Church JA. Safety and immunogenicity of live varicella vaccine in children with Human Immunodeficiency virus type 1. Pediatr Infect Dis 25:368-370, 2006.
54. Wise RP, Salive ME, Miles Braun, M, et al. Post-licensure safety surveillance for varicella vaccine. JAMA 284:1271-79, 2000.
55. Son MS, Shapiro ED, LaRussa P, et al. Effectiveness of varicella vaccine in children infected with HIV. J Infect Dis 201:1806-10, 2010.
56. Rotavirus vaccines: an update - Position Paper. Weekly Epidemiological Record. 2009; Accessed 20/08/2010. www.who.int/wer/2009/wer8451_52.pdf.
57. Steele AD, Cunliffe N, Tumbo J, Madhi SA, De Vos B, Bouckenooghe A. A review of rotavirus infection in and vaccination of human immunodeficiency virus-infected children. J Infect Dis 200(Suppl.1):S57-62, 2009.
58. Veit O, Niedrig M, Chapuis-Taillard C, et al. Immunogenicity and safety of yellow fever vaccination for 102 HIV-infected patients. Clin Infect Dis 48:659-66, 2009.
59. Revised BCG vaccination guidelines for infants at risk for HIV infection - WHO position paper. Weekly Epidemiological Record. 2007; Accessed 21/7/2010. www.who.int/immunization/wer8221bcg_May07_position_paper.pdf.
60. Hesseling AC, Cotton MF, Fordham von Reyn C, Graham SM, Gie RP, Hussey GD. Consensus statement on the revised World Health Organization recommendations for BCG vaccination in HIV-infected infants. Int J Tuberc Lung Dis 12:1376-9, 2008.
61. Hessling AC, Marais BJ, Gie RP et al. The risk of disseminated bacillus Calmette-Guérin (BCG) disease in HIV-infected children. Vaccine 25:14-18, 2007.
62. Fallo A, Torrado L, Sanches A, Cerqueiro C, Schargrodsky L, Lopez EL. Delayed complications of bacillus Calmette-Guérin (BCG) vaccination in HIV-infected children. International AIDS society conference, Rio de Janeiro, Brazil, 24-27 July 2005.
63. Nuttall JJ, Davies MA, Hussey GD, Eley BS. Bacillus Calmette-Guérin vaccine-induced complications in children treated with highly active antiretroviral therapy. Int J Infect Dis 12:e99-105, 2008.
64. Rabie H, Violari A, Madhi S, et al. Complications of BCG vaccination in HIV-infected and -uninfected children: (Children with HIV Early Antiretroviral Therapy) CHER Study. 15th Conference on Retroviruses and Opportunistic Infections, Boston, 3-6 February 2008. Abstract #600.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



