|
Coautores
Marisa Vescovo* Mónica Cufré* Marcela Natiello** Ana García** Pablo González Montaner***
Médica, Hospital de Enfermedades Infecciosas Francisco J Muñiz, Buenos Aires, Argentina*
Médica, Instituto de Tisioneumonología "Prof.Dr.R.Vaccareza", Buenos Aires, Argentina**
Médico, Instituto de Tisioneumonología "Prof.Dr.R.Vaccareza", Buenos Aires, Argentina***
|
|
Recepción del artículo: 28 de junio, 2010
|
|
Aprobación: 30 de agosto, 2010
|
 Conclusión breve
Conclusión breve
La información sobre seguridad, tolerabilidad y eficacia acerca de drogas potencialmente útiles en el tratamiento de la tuberculosis extensamente resistente es de extrema utilidad, no sólo para mejorar el pronóstico individual de estos pacientes sino también para controlar su diseminación.
 Resumen
Resumen
La tuberculosis extensamente resistente a múltiples drogas (XDR-TB) (resistente a isoniacida, rifampicina, alguna fluoroquinolona y al menos una entre kanamicina, amikacina o capreomicina), ha sido descrita en la mayoría de las regiones del mundo con efectos devastadores. Por esta razón, la información sobre seguridad, tolerabilidad y eficacia acerca de drogas potencialmente útiles en su tratamiento es de extrema utilidad, no sólo para mejorar el pronóstico individual de estos pacientes sino también para controlar su diseminación. Se presentan 18 casos de localización pulmonar en pacientes sin sida. Se trataron con esquemas que incluyeron en todos los casos linezolida; en 13, moxifloxacina, y en 13, tioridazina, todos negativizaron al examen directo y cultivo del esputo. Once pacientes cumplieron criterios de curación, 6 están aún en tratamiento y 3 abandonaron. Diez pacientes presentaron efectos adversos, en sólo 1 caso debió suspenderse la tioridazina. La utilización de linezolid, moxifloxacina y tioridazina ha contribuido a la evolución satisfactoria de estos pacientes. Estos fármacos son considerados de utilidad en esta serie, pero deben ser empleados en centros especializados con experiencia en el manejo de la XDR-TB.
 Palabras clave
Palabras clave
tuberculosis, Mycobacterium tuberculosis, tuberculosis multirresistente, tuberculosis extensamente resistente, XDR-TB
Clasificación en siicsalud
 Artículos originales> Expertos del Mundo>
Artículos originales> Expertos del Mundo>
página www.siicsalud.com/des/expertos.php/114563
Especialidades
 Principal: Diagnóstico por Laboratorio, Neumonología,
Principal: Diagnóstico por Laboratorio, Neumonología,
 Relacionadas: Administración Hospitalaria, Bioquímica, Epidemiología, Farmacología, Infectología, Medicina Farmacéutica, Medicina Interna,
Relacionadas: Administración Hospitalaria, Bioquímica, Epidemiología, Farmacología, Infectología, Medicina Farmacéutica, Medicina Interna,
 Enviar correspondencia a:
Enviar correspondencia a:
Eduardo Abbate, Instituto de Tisioneumonología "Prof. Dr. R. Vaccareza", 1281, Buenos Aires, Argentina
 Patrocinio y reconocimiento
Patrocinio y reconocimiento
Agradecimiento: Los autores expresan su agradecimiento por la inestimable colaboración al personal del laboratorio "A. Cetrángolo" del Hospital F. J. Muñiz, Instituto de Tisioneumonología "Prof. Dr .R. Vaccareza" (Jefa: Dra. Marta Ambroggi) y de Micobacterias, Instituto Nacional de Enfermedades Infecciosas "C. G. Malbrán" (Dra. Lucía Barrera, Dra. Viviana Ritacco y Dr. Norberto Simboli) cuya valiosa tarea nos permite el manejo clínico racional de la XDR-TB.
Extensively drug-resistant tuberculosis in Argentina. Our experience
 Abstract
Abstract
Drug-resistant tuberculosis (XDR-TB), defined as the resistance to rifampin and isoniacid plus resistance to any fluoroquinolone and at least one second-line injectable drug (amikacin, kanamycin and capreomycin), has been reported in most regions of the world and poses a new threat to TB control worldwide. Thus, information on safety, tolerability and efficacy of other drugs potentially useful in the treatment of these cases is urgent to improve individual outcomes and control the spread of XDR-TB. We describe the management and treatment outcomes of 18 cases of pulmonary XDR-TB in non-AIDS patients. All patients received daily-supervised therapy with an average of 4 drugs for which their susceptibility had been documented. These schemes included linezolid in 18, moxifloxacin in 13 and thioridazine in 13. All patients became negative to sputum and culture. Eleven patients fulfilled cure criteria, 6 are still in treatment and 3 abandoned the therapy. Long term therapy was well tolerated in most patients, ten presented adverse side effects, and, for these reasons thioridazine was stopped in one patient. Linezolid, moxifloxacyn and thioridazine contributed to the satisfactory evolution of our patients. These drugs were considered useful in the reported cases and should be used in specialized centres with experience in the management of XDR-TB.
 Key words
Key words
tuberculosis, Mycobacterium tuberculosis, multidrug-resistant tuberculosis, extensively drug-resistant tuberculosis, XDR-TB
TUBERCULOSIS EXTENSAMENTE RESISTENTE EN LA ARGENTINA. NUESTRA EXPERIENCIA
|
(especial para SIIC © Derechos reservados) |
|
Artículo completo
En 2004 la Organización Mundial de la Salud (OMS) estableció que la tuberculosis (TB) era la séptima causa de mortalidad en el mundo.1 Datos más recientes muestran un aumento en el número de casos de esta enfermedad, con un estimado de 9.2 millones de casos nuevos y una mortalidad atribuida a la TB de 1.7 millones de personas en 2006.2
En los últimos años se constató la emergencia de la TB multirresistente (TBMR), definida como aquella TB provocada por bacilos resistentes al menos a la isoniazida (H) y a la rifampicina (R) (las drogas de primera línea más potentes para tratar la TB) y desde entonces su prevalencia ha ido en aumento.3-4 La evolución de la TBMR es peor que la TB producida por bacilos sensibles a la drogas. En un estudio retrospectivo realizado en Estonia, la tasa de curación alcanzó el 83.4% en ésta última, comparada con sólo 57.4% en la TBMR.5
En el nuevo milenio, la TBMR no ha podido ser controlada aún. Según la OMS se produjeron 424 203 casos en 2004, lo que constituye un importante reservorio global.6
En la actualidad surge un nuevo desafío: la TB extensamente resistente (XDR-TB), que se define como aquella que presenta bacilos resistentes a por lo menos H y R (MR), más resistencia a alguna quinolona, más uno de los siguientes tres inyectables utilizados en el tratamiento antituberculoso: capreomicina (Capr), amikacina (Amik) o kanamicina (Kn).7
La reciente emergencia de un cluster de casos de XDR-TB en KwaZulu-Natal, en Sudáfrica, mostró su efecto devastador en pacientes y personal de salud, alarmantes tasas de mortalidad en aquellos coinfectados con el virus de la inmunodeficiencia humana (VIH) y su rápida diseminación nosocomial.8
Esta forma temible de TB restringe al máximo las posibilidades de tratamiento y por lo tanto las de curación. Un estudio en Perú, de Mitnick y col., describe el manejo y evolución en pacientes con XDR-TB que fueron referidos para tratamiento individualizado.9 De los 651 pacientes estudiados, 48 (7.4%) tenían XDR-TB, los 603 restantes eran portadores de TBMR. Ninguno de los pacientes con XDR-TB estaba coinfectado por el VIH. Los pacientes recibieron tratamiento diario, supervisado con un esquema que incluía en promedio 5.3 drogas (DE 1.3) incluyendo cicloserina (Cs), un inyectable y una fluoroquinolona. De los pacientes con XDR-TB 29 (60.4%) alcanzaron la curación comparados con 400 (66.3%) de los portadores de TBMR.
La presencia de XDR-TB ha sido demostrada en varios países de todos los continentes, incluso en la Argentina.10 Recientes investigaciones demostraron que aproximadamente el 10% de los casos de MRTB se convierten en enfermos portadores de XDR-TB6-11 y en algunos casos se puede llegar a formas con resistencia a todas las drogas de segunda línea (“súper” XDR-TB).12
El objetivo de este trabajo es determinar las características epidemiológicas, clínicas, bacteriológicas y evolutivas (con esquemas terapéuticos que incluyen nuevos fármacos antituberculosos), de los pacientes con diagnóstico de XDR-TB y serología negativa para el VIH atendidos por nosotros.
Materiales y métodos
Se trata de un estudio retrospectivo en el que se analizaron los casos de XDR-TB ocurridos en pacientes con serología negativa para VIH atendidos en el Hospital General de Enfermedades Infecciosas “F. J. Muñiz” e Instituto de Tisioneumonología “Prof. Dr. R. Vaccareza” de la ciudad de Buenos Aires entre enero de 2002 y diciembre de 2008.
Se definió XDR-TB como resistencia a por lo menos H y R (que es la definición de TBMR) más resistencia a alguna fluoroquinolona y por lo menos a uno de los inyectables usados en el tratamiento de la TB (Kn-Amik-Capr).7
Se analizaron las siguientes variables: edad, sexo, nacionalidad, lugar de residencia, ocupación, asociaciones mórbidas, localización, antecedentes de tratamientos previos, patrón de resistencia, esquema terapéutico utilizado, tiempo de negativización de la baciloscopia y cultivo, efectos adversos, conducta frente a éstos y evolución de los pacientes.
Se consideró tratamiento exitoso a aquellos casos con criterios de curación (tratamiento completo con confirmación bacteriológica a su finalización); tratamiento completo (finalización del esquema terapéutico sin confirmación bacteriológica). La evolución no exitosa incluyó la muerte (fallecimiento durante el curso del tratamiento), el abandono (tratamiento interrumpido por dos o más meses consecutivos) y la recaída (aparición de un cultivo positivo en un paciente que había concluido el tratamiento).13
Las pruebas de sensibilidad se realizaron por la técnica de BACTEC14 para las drogas de primera línea: estreptomicina (S), H, R, etambutol (E). La pirazinamida (Z) se investigó mediante el método de la piramidasa de Wayne.15 Para las drogas de segunda línea: PAS, Kn y Cs se utilizó la prueba de sensibilidad tradicional en medio sólido de Lowenstein-Jensen con el agregado de drogas según la técnica de Canetti.16
La prueba de sensibilidad a ofloxacina (Oflox) se realizó empleando el método de las proporciones en medio de Lowenstein-Jensen a una concentración de 2 mg/l. Cuando la proporción de mutantes resistentes superó el 1%, el aislamiento fue considerado resistente.17
Por otra parte, se determinó la actividad de moxifloxacina (Mox) y linezolid (Lz) por microdilución en placas, inoculando 104-106 UFC/ml en caldo Dubos. Los rangos de concentraciones ensayados fueron: 16-0.5 mg/ml para Mox y 64-2 mg/ml para Lz. Las lecturas finales fueron realizadas a los 30 días de incubación a 37ºC. Para este estudio se clasificaron como sensibles a aislamientos inhibidos en el 99.9% del inóculo por una concentración de antibiótico menor al pico sérico posible de alcanzar con las dosis de uso terapéutico.17
La genotipificación de los aislamientos se realizó con fingerprinting del ADN mediante RFLP IS6110 según el método estándar internacional.18
Resultados
Entre el 1 de enero de 2002 y el 31 de diciembre de 2008 se atendieron en el Hospital “F. J. Muñiz”/Instituto de Tisioneumonología “Prof. Dr. R. Vaccarezza” de Buenos Aires 18 casos confirmados de XDR-TB con serología negativa para VIH, de los que 9 eran del sexo masculino. En relación con la edad: 9 tenían entre 20 y 39 años, 8 entre 40 y 59 y uno de 61 años (media 37 años). Trece pacientes eran argentinos, tres bolivianos y tres de nacionalidad peruana.
Con respecto al lugar de residencia, 3 pacientes residían en la Ciudad Autónoma de Buenos Aires, 2 en la provincia de Jujuy, 1 en San Juan, 1 en Córdoba, 1 en Santa Cruz y el resto en el conurbano bonaerense (provincia de Buenos Aires). En esta serie dos pacientes eran trabajadores de la salud: uno era personal de limpieza y el otro auxiliar de enfermería.
De los 18 enfermos estudiados 8 presentaban comorbilidades: 3 casos diabetes mellitus, 2 alcoholismo, 1 anemia crónica, 1 anorexia y 1 lupus eritematoso sistémico.
En la Tabla 1 se presentan las características generales de los pacientes con diagnóstico de XDR-TB. Todos presentaron localizaciones pulmonares, 17 tenían antecedentes de tratamiento previo (3 sólo habían recibido drogas de primera línea).
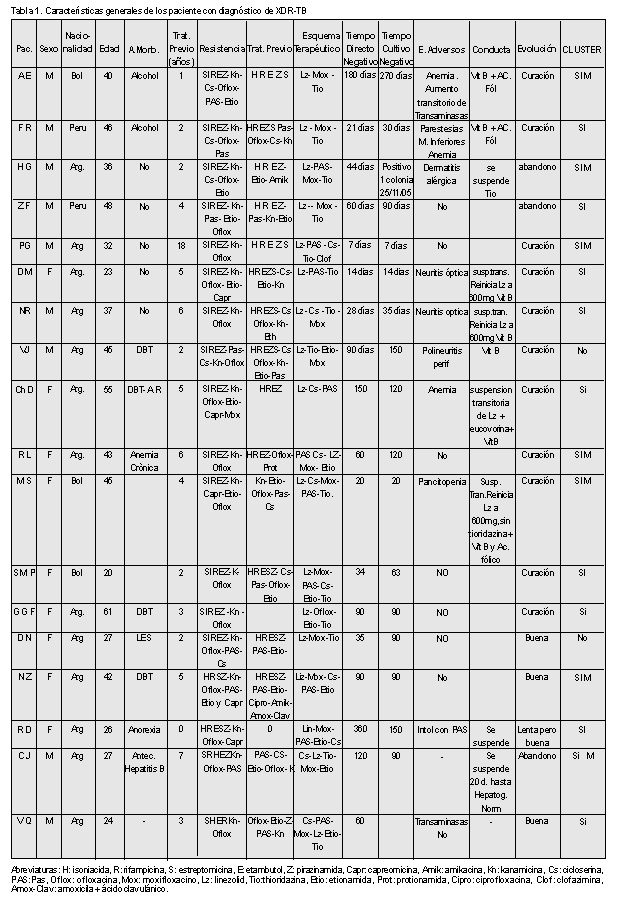
A partir del mes de noviembre de 2002, en que se obtuvo autorización del Comité de Bioética del Hospital, estos pacientes recibieron Lz, Mox y/o tioridazina (Tio) en dosis terapéuticas sumados a otros fármacos con sensibilidad conservada. Los esquemas terapéuticos utilizados incluyeron de 3 a 6 drogas. En todos los pacientes fue posible utilizar Lz, en 13 Mox y en 13 Tio.
La negativización bacteriológica al directo y al cultivo se alcanzó entre los 7 y los 360 días (Tabla 1). El esquema terapéutico fue mantenido entre 12 y 24 meses. Diez pacientes cumplieron criterios de curación, habiéndose superado los dos años de seguimiento desde la finalización del esquema terapéutico; seis se encuentran recuperados, todavía en tratamiento, y dos abandonaron.
Se observaron efectos adversos a los fármacos en 10 pacientes. Trastornos hematológicos: anemia en 3, pancitopenia en 1. Neurotoxicidad: polineuropatía periférica en 2, neuritis óptica en 2. Otros: aumento transitorio de transaminasas en 3, dermatitis alérgica en 1 e intolerancia digestiva en 1.
En los casos de toxicidad hematológica de nuestra serie, luego de la suspensión transitoria del fármaco hasta la normalización de los valores, se reinició el Lz a la mitad de la dosis (600 mg/día) con el agregado de vitamina B y ácido fólico. Sólo en el caso de la pacientes con pancitopenia, por recomendación del Servicio de Hematología se suspendió además la Tio.
En 2 casos se observó neuritis óptica tóxica que retrogradó en aproximadamente 20 días con la suspensión del Lz y el agregado de vitamina B. El diagnóstico de neuropatía tóxica fue sustentado por una pérdida aguda bilateral y simétrica de la visión con escotomas centrales y alteración de la visión de los colores.
Las cepas aisladas de los 18 pacientes fueron analizadas por RFLP, 15 estaban incluidos en clusters. Un cluster de 7 casos correspondió al patrón RFLP de la cepa M, responsable del brote nosocomial del Hospital “F. J. Muñiz”.19
Discusión
El uso inapropiado de las drogas de segunda línea en un paciente en el que ya han fracasado las de primera línea condiciona la aparición de la TBMR y XDR-TB.20 Las causas incluyen prescripción incorrecta de regímenes terapéuticos, mala calidad de los fármacos, suministro errático de las drogas, falta de adhesión por el paciente.21
Esto genera un reservorio de magnitud desconocida que al sumarse a las medidas insuficientes de control de la enfermedad facilita la transmisión a los contactos, quienes adquieren XDR-TB “primaria”.20 La adquisición de resistencia y la transmisión de cepas con farmacorresistencia contribuyen entonces a su incidencia.20,21
Las cepas virulentas de XDR-TB han emergido de cepas multirresistentes a través de la resistencia adquirida; en ciertas áreas donde los niveles de TBMR ya son altos, como Corea y Lituania, 15% a 19% de los casos con TBMR son ahora casos de XDR-TB.10 Este hecho coincide con nuestra casuística, ya que casi todos los pacientes presentaban antecedentes de tratamiento previo. Sin embargo, hay que aclarar que en 3 casos sólo habían recibido drogas de primera línea.
Es esencial prevenir la transmisión de la cepas XDR, pero también es necesario controlar efectivamente las epidemias de TBMR y así evitar que éstas se transformen en cepas XDR.22 En esta serie, la mayoría de los pacientes estaban incluidos en clusters, lo que permite concluir que la TBMR que padecieron y a partir de la cual emergió la XDR-TB había sido adquirida de una fuente común de infección, lo que avala el concepto de infección reciente.23
De forma similar, en Sudáfrica la XDR-TB se informó como un brote, lo cual por definición implica “transmisión”. El 55% de los casos no tenían historia previa de TB.8 El problema real en este caso, y desde una perspectiva de salud pública, es entonces prevenir la transmisión. La cual se exacerba en los individuos inmunocomprometidos.23
Mukherjee y col.24 plantean principios en el tratamiento de la TBMR como: usar drogas de primera línea a las que se haya documentado sensiblilidad; incluir un inyectable por un mínimo de 6 meses a partir de la negativización del cultivo; utilizar una fluoroquinolona siempre que sea posible; agregar otras drogas de segunda línea hasta alcanzar un mínimo de 4 a 5 drogas, y si hay daño parenquimatoso grave o alto grado de resistencia, considerar el uso de agentes “reforzantes” con evidencia de actividad antimicobateriana in vitro.
En primer lugar, las cepas de Mycobacterium tuberculosis con resistencia extensa, usualmente también son resistentes al resto de los fármacos de primera línea.25 Por otra parte, los fármacos sugeridos como reforzantes (amoxicilina-clavulánico, claritromicina) no mostraron actividad in vivo o los resultados son discordantes.24 Las opciones terapéuticas disponibles se ven seriamente limitadas cuando no es posible utilizar un fármaco inyectable y alguna quinolona, dos drogas bactericidas, pilares del tratamiento de la TBMR. Esta situación obliga a la búsqueda de nuevos fármacos con los cuales enfrentar este desafío.
El Lz fue la primera oxazolidona desarrollada y aprobada para el uso clínico en el tratamiento de infecciones producidas por cocos grampositivos resistentes a meticilina y vancomicina.26 Los estudios in vitro demostraron buena actividad del fármaco contra M. tuberculosis, incluyendo las cepas resistentes.27,28
La experiencia clínica con el uso de Lz en el manejo de las infecciones micobacterianas es todavía motivo de controversia. Valencia y col.29 informaron un caso de un paciente con serología positiva para VIH e infección por M. bovis multirresistente tratado en forma satisfactoria con Lz y 5 drogas más durante un período de 11 meses.
El Lz, droga del quinto grupo de la Organización Mundial de la Salud,30 fue empleado por nosotros en enfermos con MRTB con escasas posibilidades terapéuticas, ya sea por resistencia a la mayor parte de las drogas, por efectos adversos o bien por carencia de alguna de ellas, como droga de última oportunidad en tratamiento prolongado siempre asociada a otros fármacos con sensibilidad conservada.31,32 En estos enfermos se pudo observar buena evolución clínica y bacteriológica.
El mayor problema limitante relacionado con el uso prolongado del Lz en la TBMR y la XDR-TB es la toxicidad. Se observaron efectos adversos hematológicos y neurológicos cuando el fármaco se administra más de 28 días. Entre los eventos hematológicos, los más frecuentes fueron la trombocitopenia (7.5%) y la anemia (4%).33 El riesgo de mielosupresión aumenta con la duración de la terapia.34 Según la bibliografía, todos los efectos adversos hematológicos desaparecen con la suspensión del fármaco,33-35 hecho también observado en nuestra serie.
A causa de la baja CIM observada con Lz en las cepas de M. tuberculosis en relación con los niveles séricos que dicha droga puede alcanzar con dosis estándar (600 mg 2 veces por día) es posible su reducción a la mitad,28 conducta adoptada por nuestro servicio.
Otro efecto adverso del LZ utilizado en forma prolongada es la neurotoxicidad. Se comunicó neuropatía sensorial y motora y neuritis óptica tóxica.36,37 El mecanismo del daño es desconocido, aunque se ha propuesto la toxicidad mitocondrial.37 Al igual que en nuestra serie, la evolución favorable también fue comunicada por otros autores al suspender temporariamente el fármaco con el agregado de complejo vitamínico B.36,37
Un análisis retrospectivo realizado en 4 países europeos no mostró ventajas objetivas del agregado de 600 mg/día de Lz a esquemas terapéuticos individualizados para tratar MRTB o XDR-TB debido fundamentalmente a sus graves efectos adversos.38 Sin embargo, revisiones retrospectivas realizadas en los EE.UU. mostraron hallazgos más positivos.39,40
Udwadia y col.41 comunicaron recientemente su experiencia con regímenes que contienen Lz para TBMR y XDR-TB, en la India, donde hallaron mayor toxicidad que en los países europeos. Esto podría explicarse por diferencias genéticas, diferente peso corporal o estado de nutrición o por diferencias en la calidad de las drogas.42
Una dosis de 300 mg/día podría disminuir estos efectos adversos manteniendo su eficacia antimicobacteriana.43 El Lz a 300 mg/día está actualmente en investigación en una prueba piloto en Sudáfrica.44
En la búsqueda de fármacos alternativos las quinolonas demostraron ser una de las familias más prometedoras.45 De todas ellas, la Mox mostró la mejor actividad antibacteriana in vitro, este hecho puede estar relacionado con su estructura química. La CIM de esta droga es cuatro veces más baja que la de la levofloxacina.46 Su actividad bactericida es comparable a la de la H, con una importante actividad esterilizante.47,48 Es importante tener en cuenta que con el uso generalizado de las fluoroquinolonas para otras enfermedades respiratorias es posible producir tuberculosis con bacilos resistente a ellas.49 Si bien se describe resistencia completa de clase, es posible mantener sensibilidad a la Mox en casos de resistencia in vitro a ofloxacina (Oflox), como fue constatado en 13 de nuestros enfermos.
El tratamiento de las micobacterias resistentes con drogas no antibióticas es una alternativa potencial en la terapéutica de la TBMR y XDR-TB.50 La actividad in vitro de las fenotiazinas contra cepas resistentes es relevante. Con respecto a la potencia, se considera que la clorpromacina es igual a la Tio, siendo superiores a la prometazina y a la promazina.51 La Tio es indicada como droga complementaria, su mecanismo de acción propuesto es el incremento de la actividad de los macrófagos contra M. tuberculosis,52 y se considera que puede resurgir como agente antimicrobiano53 a pesar de sus efectos colaterales (somnolencia, efectos adversos cardiológicos).
En resumen, podemos afirmar que en nuestro país, donde la última encuesta de resistencias (2005) mostró una proporción de TBMR en casos nuevos de 2.2%, mientras que en casos previamente tratados fue del 15.4%,54 contar con drogas de segunda línea es fundamental para poder luchar contra este flagelo. En casos de resistencia ampliada, como la XDR-TB con escasas alternativas terapéuticas, la utilización de Lz, Mox y Tio permitió llegar a la curación en el 61% de los casos, y 22% de los casos tuvieron buena evolución y continúan en seguimiento [abandonaron 3 (17%)]. Las cifras de curación logradas en este trabajo están algo por debajo de lo publicado por nosotros hasta 2006.55
Sin embargo, podemos concluir que en nuestra experiencia, la utilización de Lz, Mox y Tio ha contribuido a la evolución satisfactoria de estos pacientes, la mayoría curados, superando los dos años de seguimiento sin recaídas.
Estos fármacos son considerados de utilidad en la serie presentada, pero deben ser utilizados en centros especializados con experiencia en el manejo de la TBMR y de la XDR-TB.
 Bibliografía del artículo
Bibliografía del artículo
1. World Health Organization. WHO Factsheet Number 310: The 10 leading causes of death by broad income Group (2004). Geneva, World Health Organization, 2008.
2. World Health Organization. Global Tuberculosis Control: surveillance, planning, financing: WHO Report 2008, Geneva. World Health Organization, 2008.
3. Edlin BR, Tokars JL, Grieco MH y col. An outbreak of multidrug-resistant tuberculosis among hospitalized patients with the acquired immunodeficiency syndrome. New Eng J Med 326:1514-21, 1992.
4. Breathnach AS, De Ruiter A, Holdsworth GM, y col. An outbreak of multidrug-Resistant tuberculosis in a London teaching hospital. J Hosp Infect 39:111-17, 1998.
5. Kliiman K, Altraja A. Predictors of poor treatment outcome in multi- and extensively drug-resistant pulmonary TB. Eur Respir J 33:1085-1094, 2009.
6. Zignol M, Hosseini MR, Wright A, y col. Global incidence of multidrug-resistant tuberculosis. J Infect Dis 194:479-85, 2006.
7. World Health Organization. Extensively drug-resistant tuberculosis (XDR-TB): recommendations for prevention and control. Weekly Epidemiol Record 81:430-32, 2006.
8. Gandhi NR, Moll A, Sturm AW, y col. Extensively drug-resistant tuberculosis as a cause of death in a patient coinfected with tuberculosis and HIV in a rural area of South Africa. Lancet 368:1575-80, 2006.
9. Mitnick CD, Shin SS, Seung KJ, y col. Comprehensive treatment of extensively drug-resistant tuberculosis. N Eng J Med 359:563-74, 2008.
10. Centers for Diseases Control and Prevention. Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs world-wide. MMWR Morb Mort Wkly Rep 55:301-05, 2006.
11. Blass SH, Mutterlein R, Weig J, y col. Extensively drug resistant tuberculosis in a high income country: a report of four unrelated cases. BMC Infect Dis 8:60-67, 2008.
12. Velayati AA, Masjedi MR, Farnia P, y col. Emergenge of new forms of totally drug-resistant tuberculosis bacilli. Chest 136:420-25, 2009.
13. Laserson KP, Thorpe LE, Leimane V, y col. Speaking the same language: treatment outcomes definitions for multidrug-resistant tuberculosis. Int J Tuberc Lung Dis 9:640-45, 2005.
14. Siddigi SH, Libonati JP, Middlebrook G. Evaluation of a rapid radiometric for drug susceptibility testing of Mycobacterium tuberculosis. J Clin Microbiol 13:908-12, 1981.
15. Wayne LG. Simple pyrazinamidasa and ureasa test for routine identificaction of Mycobactaria. Am Rev Respir Dis 109:147-31, 1974.
16. Canetti G, Rist N, Grosset J. Mesure de la sensibilité du bacilli tuberculleux aux drogues antibacillaires pour la méthode des proportions. Rev de Tuberculose 27:217-72, 1963.
17. Guidelines for drug susceptibility testing for second line anti tuberculosis drugs for DOTS-PLUS. WHO/CDS/TB 2001.288.
18. Van Embden JDA, Cave MD, Crawford JT, y col. Strain identification of Mycobacterium tuberculosis by DNA fingerprinting : recommendations for a standardized methodology. J Clin Microbiol 31:406-09, 1993.
19. Ritacco V, Di Lonardo M, Reniero A, y col. Nosocomial spread of HIV-related Multidrug-resistant tuberculosis in Buenos Aires. J Infect Dis 176:637-42, 1997.
20. Raviglione MC, Smith IM. XDR tuberculosis. Implications for global public health. N Engl J Med 356:1554-56, 2007.
21. Van Rie A, Enarson D. XDR tuberculosis: an indicator of public health negligent. Lancet 368:1554-56, 2006.
22. Blower S, Supervie V. Predicting the future of XDR tuberculosis. Lancet Infect Dis 7:443, 2007.
23. Van Helden PD, Victor T, Warren RM. The "source" of drug resistant TB outbreaks (letter). Science 314:419-20, 2006.
24. Mukherjee J, Rich ML, Socci AR, y col. Programmes and principles in treatment of Multidrug-resistant tuberculosis. Lancet 363:474-81, 2004.
25. Shah NS, Wright A, Bai GH, y col. Worldwide emergence of extensively drug- resistant tuberculosis. Emerg Infect Dis 13:380-87, 2007.
26. Ballow CH, Jones RN, Biedenbach DJ, y col. A multicenter evaluation of linezolid antimicrobial activity in North America. Diagn Microbiol Infect Dis 43:75-83, 2002.
27. Alcalá L, Ruiz-Serrano MJ, Pérez Fernández Turégano C, y col. In vitro activities of linezolid against clinical isolates of Mycobaterium tuberculosis that are susceptible or resistant to first-line antituberculous drugs. Antimicrob Agents Chemother 47:416-17, 2003.
28. Fortun J, Martin-Davila P, Navas E, y col. Linezolid for the treatment of multidrug- Resistant tuberculosis. J Antimicrob Chemoter 56:180-85, 2005.
29. Valencia ME, Moreno V, Laguna F, y col. Multiresistant tuberculosis caused by Mycobacterium bovis and human immunodeficiency virus infection. Are there new therapeutic possibilities? Enferm Infecc Microbiol Clin 19:37-39, 2001.
30. World Health Organization. Guidelines for the programmatic management of drug- resistant tuberculosis. WHO/HTM/TB/2006.361. Emergency update 2008. Executive summary (leaflet available requesting to: tbdocs@who.int).
31. Abbate E, Brea A, Cufré M, y col. Linezolid in multidrug-resistant tuberculosis treatment. Eur Respir J 24(Supppl.48):485s, 2004.
32. Abbate E, Brea A, Cufré M, y col. Linezolid en el tratamiento de tuberculosis multirresistente. Archiv Bronconeum; 40(Suppl.4): 26, 2004.
33. Gerson SL, Kaplan SL, Bruss JB, y col. Hematologic effects of linezolid: summary of clinical experience. Antimicrb Agents Chemother 46:2723-26, 2002.
34. Green SL, Maddox JC, Huttenbach ED. Linezolid and reversible myelosuppression. JAMA 285:1291, 2001.
35. Acha V, Zaragueta M, Martinez Y, y col. Linezolid induced anemia. Enferm Infecc Microbiol Clin 21:321-22, 2003.
36. Bressler AM, Zimmer SM, Gilmore JL, y col. Peripheral neuropathy associated with prolonged used of linezolid. Lancet Infec Dis 4:528-31, 2004.
37. Lee E, Burger S, Shah J, y col. Linezolid-associated toxic optic neuropathy: a report of 2 cases. Clin Infect Dis 37:1389-91, 2003.
38. Migliori GB, Eker B, Richardson MD, y col. A retrospective TBNET assessment of linezolid safety, tolerability and efficacy in multidrug-resistant tuberculosis. Eur Respir J 34:387-93, 2009.
39. Schecter GF, Scott C, True L, y col. Linezolid in the treatment of multidrug- resistant tuberculosis. Clin Infect Dis 50:49-55, 2010.
40. Condos R, Hadgiangelis N, Leibert E, y col. Case series report of a linezolid- containing regimen for extensively drug-resistant tuberculosis. Chest 134:187-92, 2008.
41. Udwadia ZF, Sen T, Moharil G. Assessment of linezolid efficacy and safety in MDR-and XDR-TB: an Indian perspective (letter). Eur Respir J 35:936-38, 2010.
42. Migliori GB, Eker B, Richardson MD y col. (Letter response). Eur Respir J 35:938-40, 2010.
43. Koh WJ, Kwon OJ, Gwak H, y col. Daily 300 mg dose of linezolid for the treatment of intractable multidrug-resistant and extensively drug-resistant tuberculosis. J Antimicrob Chemother 64:388-91, 2009.
44. Lienhardt Ch, Vernon A, Raviglione MC. New drugs regimens for the treatment of tuberculosis: review of the drug development pipeline and implications for national programmes. Current Opinion in Pulmonary Medicine 16:186-93, 2010.
45. Gillespie SH, Kennedy N. Fluoroquinolones a new treatment for tuberculosis. Int J Tuberc Lung Dis 2:265-71, 1998.
46. Rodríguez JC, Ruiz M, Climent A, y col. In Vitro activity of four fluoroquinolones against Mycobacterium tuberculosis. Int J Antimicrob Agents 17:229-31, 2001.
47. Ji B, Lounis N, Maslo C, y col. In vitro and in vivo activities of moxifloxacin and clinafoxacin against Mycobacterium tuberculosis. Antimicrob Agents Chemother 42:2066-69, 1998.
48. Hu Y, Coates AR, Mitchinson DA. Sterilizing activity of fluoroquinolones against Rifampin-tolerant populations of Mycobacterium tuberculosis. Antimicrob Agents Chemother 47:653-57, 2003.
49. Devasia RA, Blackman A, Gebretsadik T, y col. Fluoroquinolone resistance in Mycobacterium tuberculosis. Am J Respir Crit Care Med 180:365-70, 2009.
50. Kristiansen JE, Amaral L. The potential management of resistant infections with non-antibiotics. J Antimicrob Chemother 40:319-27, 1997.
51. Bettencourt MV, Bosne-David S, Amaral L. Comparative in vitro activity of phenothiazines against multi-drug resistant Mycobacterium tuberculosis. Int J Antimicrob Agents 16:69-71, 2000.
52. Amaral L, Viveiros M, Kristiansen JE. Non antibiotics: alternative therapy for the management of MDRTB and MRSA in economically disadvantaged countries. Curr Drug Targets 7:887-91, 2006.
53. Thacoody HKR. Thioridazine: resurrection as an antimicrobial agent? Br J Clin Pharmacol 64:566-574.
54. The WHO/IUATLD Global Project on antituberculosis drug resistance surveillance Anti-tuberculosis drug resistance in the world. Fourth Global Report. WHO/ HTM/TB 2008.394.
55. Abbate E, Vescovo M, Natiello M, y col. Tuberculosis extensamente resistente (XDR-TB) en Argentina: aspectos destacables epidemiológicos, bacteriológicos, terapéuticos y evolutivos. Rev Arg Med Respir 7:19-25, 2007.
|
|
©
Está
expresamente prohibida la redistribución y la redifusión de todo o parte de los
contenidos de la Sociedad Iberoamericana de Información Científica (SIIC) S.A. sin
previo y expreso consentimiento de SIIC |

|
|



